氯水显酸性、氯离子的检验等实验
王文娟1 魏锐1 于成玉2
(1)点滴板的准备
取1片点滴板,置于印有方格和数字的纸卡上。
用镊子夹取2片滤纸分别放入①孔、⑤孔中,均用1滴NaOH溶液和1滴酚酞溶液润湿。
用镊子夹取1片pH试纸放入②孔中。
向③孔中滴加6~8滴NaClO溶液。
向④孔中滴加1滴AgNO3溶液与1滴稀HNO3溶液。
用镊子夹取1片滤纸放入⑥孔中,并滴加1滴石蕊溶液润湿滤纸。
具体布局如表4所示:
表4 各试剂在点滴板中的分布

将此点滴板放入自封袋内,将盛有稀盐酸的微型塑料试剂瓶(或滴管)伸入自封袋,向③孔中滴加6~8滴盐酸,迅速将自封袋封口,稍微晃动自封袋使NaClO溶液和盐酸混合,观察实验现象。
(2) 各滴孔中观察到的现象如表5所示:
表5 点滴板各孔中实验现象
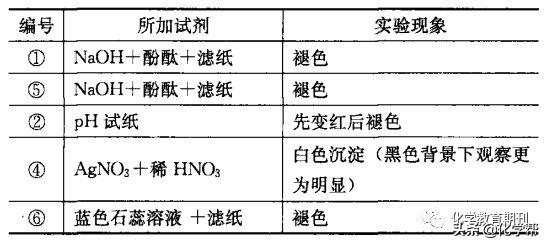
本实验中对滤纸上滴有的蓝色石蕊溶液,预期的实验现象是先变红后褪色,然而,实际现象是蓝色石蕊溶液直接褪色,无明显先变红后褪色的过程,这说明Cl2遇到蓝色石蕊溶液迅速将其漂白。
本实验①孔和⑤孔中分别“滴有1滴NaOH溶液和1滴酚酞溶液的滤纸”反应后均变成了无色,是氢氧化钠被中和还是酚酞被氧化了呢?
若仅是氢氧化钠被中和,向滤纸上滴加1滴NaOH溶液,滤纸应该变红;
若仅是酚酞被氧化,向滤纸上滴加1滴酚酞溶液,滤纸应该变红。
打开自封袋向①号和⑤号孔的滤纸上分别滴加1滴NaOH溶液和1滴酚酞溶液,观察发现2片滤纸均未变红,说明氢氧化钠和酚酞均被消耗。
这里之所以将2者放在③孔两侧,因为要进行对比,放在相等距离的两边,便于控制两处Cl2浓度近似相等。
,




