1、原理:
十二烷基硫酸钠聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate polyacrylamide gel electrophoresis,简称SDS-PAGE)是聚丙烯酰胺凝胶电泳中最常用的一种蛋白表达分析技术。此项技术的原理,是根据检体中蛋白质分子量大小的不同,使其在电泳胶中分离。聚丙烯酰胺凝胶为网状结构,具有分子筛效应,蛋白质在电场中支持物上的迁移率差异主要依赖于样品中各种分子携带的电荷,分子大小与形状的差别。聚丙烯酰胺凝胶电泳系统加入阴离子去垢剂SDS,蛋白质在加热变性以后与SDS结合,带上负电荷,在电场的作用下,向正极移动,结果按分子量大小排列在胶板上,含量多的蛋白带纹粗,蛋白质的迁移率主要取决于分子量大小。SDS-PAGE仅根据蛋白质亚基分子量的不同就可以分开蛋白质。在大肠杆菌表达纯化外源蛋白的实验中,SDS-PAGE 更是必不可少的操作,其通常用于检测蛋白的表达情况(表达量,表达分布),以及分析目的蛋白的纯度等。
2、作用机理
SDS是阴离子去污剂,作为变性剂和助溶试剂,它能断裂分子内和分子间的氢键,使分子去折叠,破坏蛋白分子的二、三级结构。而强还原剂如巯基乙醇,二硫苏糖醇能使半胱氨酸残基间的二硫键断裂。在样品和凝胶中加入还原剂和SDS后,分子被解聚成多肽链,解聚后的氨基酸侧链和SDS结合成蛋白-SDS胶束,所带的负电荷大大超过了蛋白原有的电荷量,这样就消除了不同分子间的电荷差异和结构差异。
SDS-PAGE电泳仪器
(2)灌胶与上样
玻璃板对齐后放入夹中卡紧。然后垂直卡在架子上准备灌胶。(操作时要使两玻璃对齐,以免漏胶)。根据蛋白分子量的不同配制不同浓度的分离胶,加入 TEMED后立即摇匀即可灌胶。灌胶时,用枪吸取适量的胶沿玻璃放出,待胶面升到玻璃板合适的高度即可。然后胶上加一层水(无水乙醇也可),液封后的胶凝的更快。(灌胶时开始可快一些,胶面快到所需高度时要放慢速度。操作时胶一定要沿玻璃板流下,这样胶中才不会有气泡。加水液封时要很慢,否则胶会被冲变型)。待分离胶凝固后加入浓缩胶。
胶凝好后拔出梳子,加入足够的电泳液后开始准备上样(电泳液至少要漫过内测的小玻璃板)。加样太快可使样品冲出加样孔,若有气泡也可能使样品溢出,可能造成其他孔中样品污染。
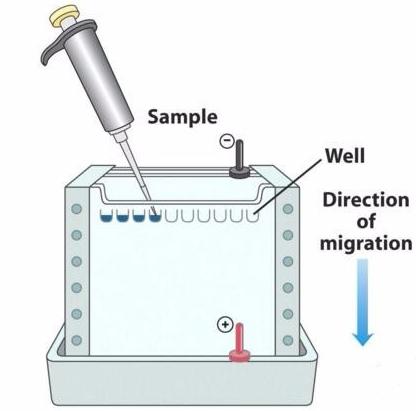
SDS-PAGE电泳上样
3、电泳
加样完毕,盖好上盖,连接电泳仪,打开电泳仪开关后,设置好电压。待样品跑至浓缩胶后再调高电压直至溴酚蓝指示剂迁移到距前沿1~2cm 处即停止电泳。
4、染色、脱色
电泳结束后,关掉电源,取出玻璃板,将胶面与一块玻璃板分开后放入大培养皿中染色,使用 0.25%的考马斯亮蓝染液,染色 2~4h,必要时可过夜。弃去染色液,用蒸馏水把胶面漂洗几次,然后加入脱色液,进行扩散脱色,经常换脱色液,直至蛋白质带清晰为止。
文章来源:每日生物评论
欢迎关注每日生物评论(Bio-review)
用最专业的精神,开放性的思维,与你一起探索行业走向,快速了解这个领域!
,




