
作者:子非鱼
常言道,生死就在呼吸之间。那么细胞好不好,全靠线粒体;线粒体到底行不行,就要靠呼吸链了。而作为线粒体中的“肺部”,呼吸链上的蛋白复合物绝对是至关重要的。

其中,这四位肱骨之臣(蛋白复合物)可以说是立下了汗马功劳。它们在持续不断地将NADH所携带的高能电子交给O2的同时,也会协同线粒体质子泵为复合物V(ATP合成酶)合成ATP提供能量。
总之,细胞之所以能在生命之路上马不停蹄地一路狂奔,完全依赖于线粒体这个“动力工厂”,日以继夜地消耗着体内储存的化学能,为细胞提供“能量货币”—ATP。
这也是为什么若想展示呼吸过程的全貌,就必先解析膜蛋白复合物结构的关键所在,近年来世界范围内的一大批顶尖科学家都为之奋斗。其中,来自中国的科学家在激烈的国际竞争中多次脱颖而出。
呼吸链的认知史
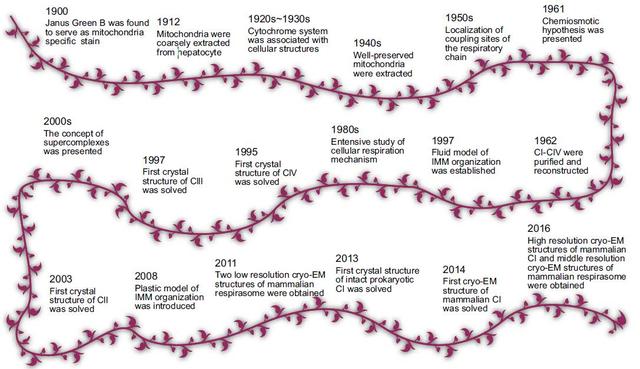
显然在1900年至1961年期间,各类氧化还原酶类以及进行电子传递的辅基才纷纷如雨后春笋般纷纷冒出,而随着结构生物学尤其是X射线晶体学的发展,呼吸链上复合物CⅣ、Ⅲ、Ⅱ、V和Ⅰ的晶体结构在1962年至2000年被逐渐解析。
2005年,我国著名结构生物学家饶子和研究组则首次从猪心中获得了首个哺乳动物线粒体复合物Ⅱ的高分辨率三维晶体结构,确定了该复合物是一个跨膜蛋白质复合物,而不是一个外周膜蛋白,并验证了电子传递体的氧化还原电位是受其周围的氨基酸环境调控的。这是线粒体呼吸链研究领域中一个里程碑式的发现,填补了线粒体结构生物学和细胞生物学领域中的一个空白。

然而呼吸链上的蛋白复合物并不是完全独立存在的,而是可以不同的组合方式相互结合形成更高级的组织形式——超级复合物,其中具有完整呼吸活性的超级复合物又被称之为呼吸体。此时,超级复合物的出现也标志着科学家对呼吸链的研究进入了第三阶段。
因物种来源的不同,超级复合物的组成形式差异也很大,如酵母中最主要形式为Ⅲ2Ⅳ1,土豆微管组织中的主要形式为Ⅰ1Ⅲ2,哺乳动物中最为常见的呼吸体形式为Ⅰ1Ⅲ2Ⅳ1。有时甚至在同一个物种中,正常的生理条件下也同样存在不同组成形式的超级复合物。

当时尽管对呼吸链上每个单独复合物的电子传递以及转运质子的分子机制已经有所了解,但是复合物之间的电子传递并不清楚。直至近年来冷冻电镜领域获得了革命性的突破,抓住机遇的清华大学杨茂君课题组才率先在线粒体呼吸链超级复合物领域取得一系列重要突破。
杨茂君:线粒体呼吸链研究的先驱者
2012年,清华大学杨茂君课题组率先在Nature解析酵母来源的Ⅱ型线粒体复合物1(Ndi1)的高分辨率晶体结构以及及Ndi1与NADH、UQ以及NADH-UQ三种底物复合物的晶体结构,并应用电子自旋共振(Electron Spin Resonance, ESR)方法揭示了Ndi1中同时存在两个泛醌(UQI,UQII)结合位点。

时隔五年后,杨教授研究组又分别在《PCCP》、《JMC》等杂志连续报道了NDH2的详细电子传递机制,同时开发了以疟原虫NDH2为靶标的针对耐药性疟原虫的新型抗疟疾药物前体分子,为开发新的治疗疟疾的药物打下了良好的基础。
经过多年的努力,杨茂君研究组于2016年终于攻克了哺乳动物线粒体呼吸链超级复合物的原子分辨率结构这一国际性难题。
9月,杨茂君研究组在Nature发表题为“The architecture of the mammalian respirasome”的研究论文首次报道了线粒体呼吸链超级复合物(Ⅰ1Ⅲ2Ⅳ1,由一个复合物Ⅰ、两个复合物Ⅲ和一个复合物Ⅳ构成)的原子分辨率(整体5.4Å)冷冻电镜三维结构,其中复合物Ⅰ和复合物Ⅲ的分辨率达到3.97Å。
而之前的两篇分辨率分别为4.2Å和3.9Å的针对哺乳动物线粒体呼吸链复合物Ⅰ(CI)结构的Nature论文也从侧面证明了杨茂君教授研究组对超级复合物结构解析的正确性。

呼吸链超级复合物Ⅰ1Ⅲ2Ⅳ1整体结构(M,基质;IM,线粒体内膜;IMS,膜间隙)
研究者发现该膜蛋白超级复合物是由81个蛋白亚基(70种不同蛋白分子)所构成的,且分子量高达1.7MDa。其中,在CⅠ与CⅢ的跨膜区有一个缝隙,很可能是辅酶Q储存和流动的场所。
CⅣ与CⅠ之间没有直接的电子传递载体的交流,而CⅣ和CⅢ中结合细胞色素c的位点都位于线粒体膜间隙且在同一平面上且之间的距离非常接近,这样的结构特点会促进CⅢ与CⅣ之间细胞色素c的交流。
同时,该课题组也详细阐述了呼吸链复合物自身是如何保持自身结构的稳定性的。复合物中CⅠ与CⅢ之间的相互作用非常紧密,跨膜区内CⅠ中的蛋白亚基NDUFA11可以与CⅢ中的蛋白亚基UQCRB和UQCRQ发生相互作用。同时,CⅠ中的NDUFB4和NDUFB9亚基还与CⅢ中的UQCRC1直接相互作用,进一步加强CⅠ与CⅢ之间的联系。
而CⅣ与CⅠ和CⅢ之间的相互作用则相对较弱,CⅣ中的蛋白亚基COX7C与CⅠ中的ND5相互作用,而CⅣ中的COX7A与CⅢ中的UQCRC1和UQCR11有相互作用。
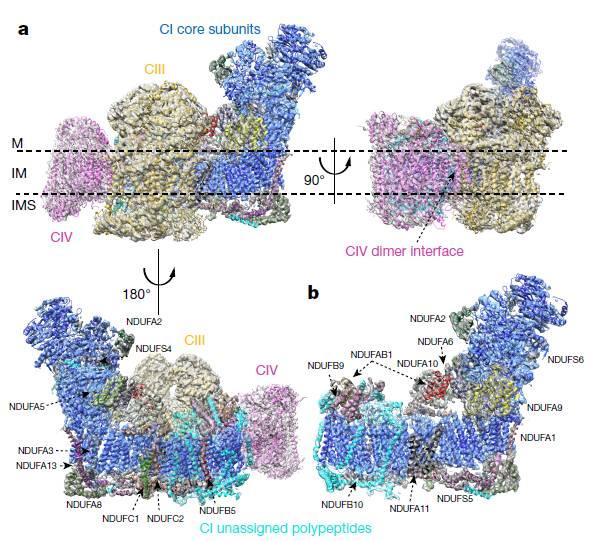
不同侧面呼吸体结构模型及密度。b,复合物I结构模型及密度。(M,基质;IM,线粒体内膜;IMS,膜间隙)
随后,杨茂君研究组通过不断创新蛋白纯化技术和电镜数据处理方法,成功将呼吸体结构的原子分辨率提升至3.3-3.9Å,并解析了迄今为止分辨率最高的哺乳动物呼吸链最大最复杂复合物Ⅰ(Ⅰ1Ⅲ2Ⅳ1)的精细结构(3.3-3.6Å)。同年12月,他们将该项研究成果发表在Cell上。

呼吸链复合物Ⅰ整体3.6 Å密度图(M,基质;IM,线粒体内膜;IMS,膜间隙)
考虑到呼吸体中复合物Ⅰ、Ⅲ、Ⅳ的空间相对位置,杨茂君教授提出了全新的电子传递模型,即辅酶Q从复合物Ⅰ扩散至复合物Ⅲ传递电子的过程并不需要翻转,并且Q-Cycle模型中的Qi位点才是辅酶Q的真正结合位点。该模型与目前占统治地位的、1975年由诺贝尔奖获得者Peter Mitchell提出的Q-循环(Q-Cycle)理论完全不同。
依据呼吸体的原子分辨率结构,复合物的蛋白亚基之间存在着复杂而细致的相互作用,这也说明了呼吸体是一个非常精密的大分子机器,而人们对这一精密机器的理解还处于起步阶段。
另外,杨教授还发现磷脂分子包括心磷脂、磷脂酰胆碱和磷脂酰乙醇胺等,在呼吸体蛋白亚基的相互作用中所起到的关键作用。
近日,杨教授最新发表的Cell论文突破性地解析了人源呼吸链蛋白质复合物最高级的组织形式——超-超级复合物(MCⅠ2Ⅲ2Ⅳ2,17.4 Å)的高分辨率三维结构(近乎中心对称的环形结构)以及超级复合物(SCⅠ1Ⅲ2Ⅳ1,3.9 Å)的原子分辨率结构,从而第一次直接证明了高于呼吸体的呼吸链超超级蛋白复合物的组织形式的存在。

文章中观察到了呼吸链超超级复合物Ⅰ2Ⅲ2Ⅳ2中的复合物Ⅲ二聚体中存有两个可结合细胞色素c蛋白位点,充分证明了两个复合物Ⅲ的单体都是有活性的,并否定了之前其他研究组提出的复合物Ⅲ半失活理论。而此结果进一步支持了杨教授之前提出的全新的电子传递模型。
另外,杨教授研究组还通过计算机模拟的方法首次将复合物Ⅱ的结构嵌入进呼吸链超级复合物的模型之中,并推论出呼吸链中四个电子传递链蛋白将组合成一个更大的超-超级复合物Ⅰ2Ⅱ2Ⅲ2Ⅳ2来更高效的发挥功能,为之后的研究提供了一条新的思路。
这一系列结构的解析不仅阐明了线粒体呼吸链复合物的作用方式及反应机理,也为人类攻克线粒体呼吸链系统异常所导致的疾病(如阿兹海默综合症、帕金森综合症、多发性硬化、少年脊髓型共济失调以及肌萎缩性脊髓侧索硬化症等)提供了一个良好的开端。
参考文献:
1. Crystal structure of mitochondrial respiratory membrane protein complex II
(doi:10.1016/j.cell.2005.05.025 )
2. Architecture of Human Mitochondrial Respiratory Megacomplex I2III2IV2.
(doi:http:// dx.doi.org/10.1016/j.cell.2017.07.050)
3.The architecture of the mammalian respirasome.(doi:10.1038/nature19359).
4.Structure of Mammalian Respiratory Supercomplex I1III2IV1.(doi:10.1016/j.cell.2016.11.012)
5.Amazing structure of respirasome: unveiling the secrets of cell respiration.
(doi:10.1007/s13238-016-0329-7)
6.Structural insight into the type-II mitochondrial NADH dehydrogenases.
(doi:10.1038/nature11541)
7. Temperature-dependent ESR and computational studies on antiferromagnetic electron transfer in the yeast NADH dehydrogenase Ndi1.
(doi:10.1039/c6cp08107j)
8. Target Elucidation by Cocrystal Structures of NADH-Ubiquinone Oxidoreductase of Plasmodium falciparum (PfNDH2) with Small Molecule To Eliminate Drug-Resistant Malaria.
(doi:10.1021/acs.jmedchem.6b01733)
欢迎投稿
tougao@helixlife.com.cn
合作helixlife6
,




