作者:思宇研究院官方
前言
相信大多数奋斗在一线的医疗器械研发者都会收到这样一条设计需求:医生使用起来顺手。简简单单的一条,但是你可能为此修改数遍图纸,薅掉一撮撮头发,自己也无法确认是否满足了这条设计需求。人们评论医疗器械设计的好坏也通常是说“好不好用”。这些所谓的“顺不顺手”、“好不好用”便是我们今天想要谈的人因工程。之所以说它隐形,因为它并没有明确技术指标,而更多的因人而异在外观形态、材质工艺、人机界面,甚至工艺、色彩等方面更多考虑使用者的感受。相较于满足医疗器械的使用功能,人因工程让医疗器械更有人情味。

(英国5分位数女性与95分位数男性手掌大小对比)
一、什么是人因工程?
人因工程(Human FactorsEngineering,HFE)最早起源于二战时期,设计人员在研发新式武器时研究如何兼顾机器特性和人的体能极限而诞生的。但至今学科名称和定义也尚未统一。一种普遍的定义是:一门以心理学、生理学、解剖学、人体测量学等学科为基础,研究如何使人-机-环境系统的设计符合人的身体结构的生理心理特点,以实现人、机、环境之间的最佳匹配,使处于不同条件下的人能有效地、安全地、健康和舒适地进行工作与生活的科学。人因工程作为一门科学,并没有拥有其他学科那样繁杂的公式,也没有规定必须要做什么,而是提出一个问题:怎样让设备更好、更安全、更高质量?人因工程常常让研发工程师挠破头的原因也正在于它让我们在to be better 的道路上永不止步。
二、人因工程在医疗器械中的重要性
从上面的定义我们可以知道,人因工程的终极目标是设计优化出用户最适用的产品,即最高效的人-机交互系统。
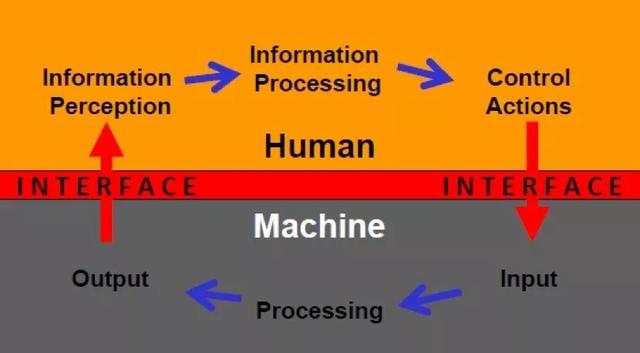
(人-机交互模式)
来源:FDAPerspectives on Human Factors in Device Development
医疗器械作为一类特殊的设备,它直接与人的生命安全联系,因此安全、有效是其设计的重中之重。人因工程在医疗器械的设计中到底扮演着神秘角色呢?我举一个简单的例子。相信大家对自动体外心脏除颤器(AED)都不陌生,它用于帮助心脏骤停、心室颤动的病人恢复心率,下图便是常见的AED。

(常见AED)
我们试想一下其工作场景:使用者通常是未经专业医疗培训的路人,在及其紧张的情况下第一次(或者为数不多的几次)使用AED在“黄金四分钟”对心脏骤停病人进行救治。在这4分钟内,他首先需要从安装盒中取出AED,阅读并理解各个按钮含义,听清并理解AED常用的电子语音指令或视频操作指示,并根据指令进行正确操作,如给患者贴电极,按下“分析”按钮等,并且在分析完毕后按下“电击”按钮等。人因工程的作用便是在这个过程中保证使用者正确执行操作的同时避免误操作,如通过文字、颜色、图标等标识不同按钮功能,设计按钮的形状、位置,尽量避免使用者误触等。

(常见AED外观图)
除了保证医疗器械的安全性之外,提升可用性也是人因工程的重要作用。在治疗过程中,医生不仅承受着难以想象的精神压力,同时也面对着高强度的体力考验。人因工程专家的目标便是努力降低操作者疲劳程度,使其尽可能处于舒适界限。如下面这个操作台车,设计者不仅需要考虑人体高度,人体各部分长度以及仪器外观等因素来设计台车的外形尺寸,还需要依据人体生物力学特性设计合理的操作方式,尽量减小操作位移,减轻操作医师的体力消耗。此外,还应设计简洁的人机交互界面,合理排布菜单、按钮等,减少使用时的错误率。而这些仅仅针对使用时的一些粗略的总结,还没有包括设备的运输、维修等方方面面的人体工效学设计。

人因工程是一个庞大、复杂、且需要经过不断测试的系统工程,虽然近年来人因工程的引入让医疗器械的安全性、有效性等方面有了较大改善,但远未达到完善的程度。继续开展医疗器械人因工程设计,利用人因工程指导医疗器械研发,不断完善、优化医疗器械性能,让使用者更高效、舒适地使用各种器械,仍是摆在广大医疗器械研发工程师和人因工程专家面前的迫切需求。
三、医疗器械人因工程相关监管要求
由于人因工程在医疗器械有效性、安全性上起到的关键作用,越来越多的国家将其列入医疗器械行业的监管要求。美国应该是最早将人因工程引入医疗器械监管的国家。20世纪70年代和80年代,FDA的研究曾表明用户界面设计缺陷导致患者死亡。为此,美国医疗器械促进协会(AAMI)将军事装备的人因工程标准MIL-STD-1472调整后使其适用于医疗器械,从而成为首个医疗器械HFE指导文件。1996年,FDA推进质量体系法规修订时,针对人因工程已经有了明确规定,使得医疗器械开发中必须应用HFE法律规定。

1999年,美国国家医学院刊登了一份报告,据该报告估计,每年有4.4~9.8万美国居民死于医疗事故,而超过1/3是由于医疗器械的使用错误——在器械的开发过程中未能充分考虑人体工效学。该报告引起了FDA高度重视,并在第二年就颁布了医疗器械安全使用指南——《Medical DeviceUse‐Safety: Incorporating Human Factors Engineering into Risk Management》,强调了对人因工程的正确应用,以此减少此类错误造成的人员伤亡。
此后,AAMI又相继发布了AAMI HE74:2001(已于2010年撤销)和AAMI HE75:2009,但这两个标准均为自愿性标准。21世纪初,国际电工委员会(IEC)也制定了名为IEC 60601-1-6的标准,发布了与AAMI HE74:2001中规定应用HFE的类似方法。2007年,IEC发布IEC62366:2007,基本取代IEC60601-1-6。
美国FDA此前一直认可IEC标准,直至2011年,FDA发布自己的HFE指南《Draft Guidance-Applying Human Factors and Usability Engineering to Optimize Medical Device Design》,该指南90%与IEC重叠,但规定制造商在获得最终产品批准前必须执行全面的HFE工作,FDA高度期望制造商进行可用性测试。这也意味着想要获得FDA认证,必须要进行相关可用性测试。
欧盟也在2007年发布的MD2007/47/EEC医疗器械指令中明确指出,制造商应对国家认证测试实验室编制的测试报告表进行全面审查,以评估遵守标准的情况,即其医疗产品应符合IEC的HFE标准才能获得CE认证。
可用性作为一项全新的监管要求,在我国尚处于起步阶段,我国在2016年发布YY/T 1474-2016:医疗器械可用性工程对医疗器械的应用,这是我国医疗器械人因工程从研究走向监管卖出的第一步。尽管人因工程相关要求在CFDA认证过程中更多的是指导性文件,但是也给我们透出一个信号,从研发环节就引入人因工程监管,不断完善改进相关法规,更好保证医疗器械安全、有效是我国相关部门持续推进的事情。
结语
医疗器械设计是多重学科融合、临床需求突出的工作,医疗器械工程师应注重医工结合,充分了解产品用途、使用环境、产品生命周期、使用对象等多重影响因素,审慎评估风险程度,结合可用性测试,合理预见并降低误操作出现的概率,提升产品使用安全性与舒适性,做出真正安全且有人情味的医疗器械。卓越与灾难之间,或许就差着这么一点人情味~
- END -
作者 许珂 | 编辑 刘稷轩 | 排版 Elsa
本文转载自其他网站,不代表健康界观点和立场。如有内容和图片的著作权异议,请及时联系我们(邮箱:guikequan@hmkx.cn)
,




