专题一 物质的组成 分类 性质
考试说明要求
解读:分类与比较的方法是重要的化学思想方法之一,在中学阶段,认识化学物质以及化学反应的基本视角之一就是依据物质的组成、性质对物质进行分类,归纳出一类物质所具有的通性,将物质所具有的特性作为规律的特例处理,体现了化学学科思想中的“一般与特殊”的思想。所以,我们不能仅仅只是将物质的组成、分类、性质作为具体知识进行学习,而是应该作为化学学习的一种基本方法进行使用,也就是看见一个物质(熟悉的或陌生的),首先有意识的根据其组成进行分类,再依据所属类别的通性推测其应该具有的性质,然后根据题目信息综合考虑有无特性或特殊反应,最后按要求解题。分类的方法在解决化学问题时往往是一把“金钥匙”。
知识梳理
一、物质的组成

离子化合物
1.纯净物与混合物的区别
由一种物质组成的是纯净物,由两种或多种物质组成的是混合物。对于由分子组成的物质,纯净物由同种分子构成,混合物由两种或多种分子构成,每种分子都保持原有的化学性质。
常见混合物:
① 分散系(如溶液、胶体、浊液等);
② 高分子化合物(如蛋白质、纤维素、聚合物、淀粉等);
③ 常见特殊名称的混合物:
注意:由同种元素构成的物质不一定是纯净物,例如同素异形体组成的混合物。具有相同组成的物质(如最简式、分子式相同)也不一定是纯净物。因此,不能由化学式来判断是否是纯净物,要充分考虑其结构,要考虑同素异形体或同分异构体。
2. 氧化物(由两种元素组成,其中一种元素是氧元素的化合物)
3. 酸(在溶液中电离出的阳离子全部是H 的化合物)
4. 碱(在溶液中电离出的阴离子全部是OH-的化合物)
5. 盐(由金属阳离子或NH4 和酸根离子构成的化合物)
三、物质的性质和变化
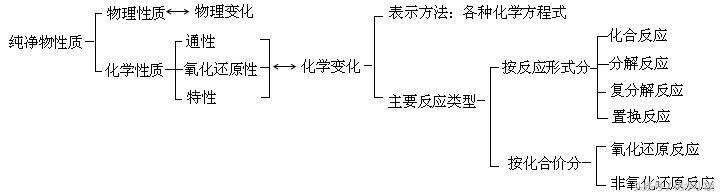
1.物理变化和化学变化

(1)酸、碱、盐、氧化物之间的反应规律
注:此规律指一般情况下的反应,不能包括
有关物质之间的所有反应情况。
① 金属跟氧气反应
在金属活动性顺序表中除Ag、Pt、Au 外,
都能跟O2 化合,多数生成碱性氧化物
(Mn2O7、Al2O3 等不是碱性氧化物)
② 碱性氧化物跟水反应
碱性氧化物对应的水化物越易溶于水,
反应越易进行。
③ 不溶性碱受热分解。
④ 非金属跟氧气反应。
⑤ 酸性氧化物跟水化合
酸性氧化物对应的水化物越易溶于水,反应越易进行。
⑥ 含氧酸加热分解一般生成酸酐和水。
但硝酸分解较复杂,是自身氧化还原反应。硝酸见光或受热分解生成二氧化氮、氧气和水。
⑦ 金属与非金属(除O2)反应一般生成无氧酸盐。
⑧ 碱性氧化物跟酸性氧化物化合生成含氧酸盐。
⑨ 碱性氧化物跟酸反应生成盐和水。
⑩ 酸性氧化物跟碱反应生成盐和水。
酸碱中和。
酸跟盐反应生成新酸和新盐
a.强酸制弱酸。
b.高沸点酸制低沸点酸。
c.多元弱酸的正盐跟酸反应生成酸式盐
d.碱式盐跟酸反应。
e.弱酸的酸式盐跟强酸反应。
碱跟盐反应生成新碱与新盐。
a.易溶性碱制难溶性碱。
b.难溶性碱转化成更难溶的碱。
盐跟盐反应
a.生成沉淀。
b.沉淀转化。
c.水解互促。
d.氧化还原反应。
金属跟不活泼金属盐发生置换反应。
金属跟酸反应
a.氢前金属跟非氧化性酸反应生成盐和氢气。
b.金属与氧化性酸(浓H2SO4、浓、稀HNO3)反应生成盐、低价态的非金属氧化物、水。
(2)质量守恒定律(两层含义)
① 参加化学反应的各物质的质量总和 反应后生成的各物质的质量总和。质量守恒定律是书写反应化学方程式的依据。
② 参加化学反应的各元素的原子在反应前后物质的量 。
(3)电荷守恒定律(一般体现有三种情况)
① 任何一种化合物,其组成中阴、阳离子所带的电荷数 ,电性 。
例:20 mL浓度为0.05 mol/L的含Mn 的溶液,恰好把15 mL浓度为0.1 mol/L的含S2-溶液中的S2-全部沉淀,则n= 。
② 任何一种溶液,其所含的各种阴离子所带的电荷数之和 各种阳离子所带的电荷数之和,电性相反。
例:由硫酸钾、硫酸铝和硫酸组成的混合溶液,其pH=1,c(Al3 )=0.4 mol/L,
c(SO42-)=0.8 mol/L,则c(K )= mol/L。
③ 配平的离子方程式,两边各种微粒所带的电荷的代数和 。
例:水溶液中RO3n-与S2-在酸化后发生反应:RO3n- 3S2- 6H =R- 3S 3H2O。
(1)RO3n-中n为 。
(2)R原子最外层有 个电子。
,




