硫酸(化学式:H2SO4),硫的最重要的含氧酸。无水硫酸为无色油状液体,10.36℃时结晶,通常使用的是它的各种不同浓度的水溶液,用塔式法和接触法制取。前者所得为粗制稀硫酸,质量分数一般在75%左右;后者可得质量分数98.3%的浓硫酸,沸点338℃,相对密度1.84。
硫酸是一种最活泼的二元无机强酸,能和绝大多数金属发生反应。高浓度的硫酸有强烈吸水性,可用作脱水剂,碳化木材、纸张、棉麻织物及生物皮肉等含碳水化合物的物质。与水混合时,亦会放出大量热能。其具有强烈的腐蚀性和氧化性,故需谨慎使用。是一种重要的工业原料,可用于制造肥料、药物、炸药、颜料、洗涤剂、蓄电池等,也广泛应用于净化石油、金属冶炼以及染料等工业中。常用作化学试剂,在有机合成中可用作脱水剂和磺化剂。
物流性质纯硫酸一般为无色油状液体,密度1.84 g/cm³,沸点337℃,能与水以任意比例互溶,同时放出大量的热,使水沸腾。加热到290℃时开始释放出三氧化硫,最终变成为98.54%的水溶液,在317℃时沸腾而成为共沸混合物。硫酸的沸点及粘度较高,是因为其分子内部的氢键较强的缘故。由于硫酸的介电常数较高,因此它是电解质的良好溶剂,而作为非电解质的溶剂则不太理想。硫酸的熔点是10.371℃,加水或加三氧化硫均会使凝固点下降。
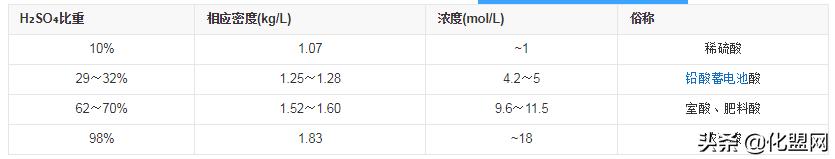
- 浓度的差异
尽管可以制出浓纯净的硫酸,并且室温下是无限稳定的(所谓的分解成恒沸物的反应发生在接近沸点的高温之下),但是纯硫酸凝固点过高(283.4K),所以为了方便运输通常制成98%硫酸,故一般所说的“高浓度硫酸”指的便是浓度为98%的硫酸。另外,硫酸在不同的浓度下有不同的应用,以下为一些常见的浓度级别。硫酸亦可被制成其他形态。例如,将高浓度的SO3通入硫酸可制成发烟硫酸,有关发烟硫酸的浓度,人们通常以SO3的百分比作准或者是H2SO4的百分比作准,两者均可。一般所称的“发烟硫酸”的浓度为45%(含109%H2SO4)或65%(含114.6% H2SO4)。当SO3与H2SO4比例为1:1产物为焦硫酸(H2S2O7),焦硫酸为固体,熔点为36℃。
- 极性与导电性
纯硫酸是一种极性非常大的液体,其介电系数大约为100。因为它分子与分子之间能够互相质子化对方,造成它极高的导电性,这个过程被称为质子自迁移。发生的过程是:2H2SO4⇌H3SO4 HSO4-(主要)2H2SO4⇌H3O HS2O7-H3O H2SO4⇌H3SO4 H2OHS2O7- H2SO4⇌HSO4- H2S2O7
化学性质
腐蚀性
纯硫酸加热至290℃分解放出部分三氧化硫,直至酸的浓度降到98.3%为止,这时硫酸为恒沸溶液,沸点为338°C。无水硫酸体现酸性是给出质子的能力,纯硫酸仍然具有很强的酸性,98%硫酸与纯硫酸的酸性基本上没有差别,而溶解三氧化硫的发烟硫酸是一种超酸体系,酸性强于纯硫酸,但是广泛存在一种误区,即稀硫酸的酸性强于浓硫酸,这种想法是错误的。的确,稀硫酸第一步电离完全,产生大量的水合氢离子H3O ;但是浓硫酸和水一样,自身自偶电离会产生一部分硫酸合氢离子H3SO4 ,正是这一部分硫酸合质子,导致纯硫酸具有非常强的酸性,虽然少,但是酸性却要比水合质子强得多,所以纯硫酸的哈米特酸度函数高达-12.0。
在硫酸溶剂体系中,H3SO4 经常起酸的作用,能质子化很多物质产生离子型化合物:
NaCl H2SO4==NaHSO4 HCl(不加热都能很快反应)
KNO3 H2SO4→K HSO4- HNO3
HNO3 H2SO4→NO2 H3O 2HSO4-
CH3COOH H2SO4→CH3C(OH)2 HSO4-
HSO3F H2SO4→H3SO4 SO3F-(氟磺酸酸性更强)
上述与HNO3的反应所产生的NO2 ,有助于芳香烃的硝化反应。
浓硫酸特性
1.脱水性
脱水指浓硫酸脱去非游离态水分子或按照水的氢氧原子组成比脱去有机物中氢氧元素的过程。就硫酸而言,脱水性是浓硫酸的性质,而非稀硫酸的性质,浓硫酸有脱水性且脱水性很强,脱水时按水的组成比脱去。物质被浓硫酸脱水的过程是化学变化,反应时,浓硫酸按水分子中氢氧原数的比(2:1)夺取被脱水物中的氢原子和氧原子或脱去非游离态的结晶水,如五水硫酸铜(CuSO4·5H2O)。
可被浓硫酸脱水的物质一般为含氢、氧元素的有机物,其中蔗糖、木屑、纸屑和棉花等物质中的有机物,被脱水后生成了黑色的炭,这种过程称作炭化。一个典型的炭化现象是蔗糖的黑面包反应。在200mL烧杯中放入20g蔗糖,加入几滴水,水加适量,搅拌均匀。然后再加入15mL质量分数为98%的浓硫酸,迅速搅拌。观察实验现象。可以看到蔗糖逐渐变黑,体积膨胀,形成疏松多孔的海绵状的炭,反应放热,还能闻到刺激性气体。
C12H22O11==浓硫酸==12C 11H2O
同时进行碳与浓硫酸反应:
C 2H2SO4(浓)==加热==CO2↑ 2SO2↑ 2H2O
2.强氧化性
还原产物
浓硫酸由于还原剂的量,种类的不同可能被还原为SO2,S或H2S: [4]
例如,还原剂过量时,HBr,H2S和HI分别将浓硫酸还原为不同物质: [4]
2HBr H2SO4(浓) = Br2 SO2 2H2O
3H2S H2SO4(浓) = 4S↓ 4H2O
8HI H2SO4(浓) = 4I2 H2S 4H2O
还原剂量不同时,产物也可能有所不同: [4]
Zn 2H2SO4(浓) =ZnSO4 SO2↑ 2H2O
3Zn 4H2SO4(浓) = 3ZnSO4 S 4H2O
4Zn 5H2SO4(浓) = 4ZnSO4 H2S↑ 2H2O
相关反应
(1)与金属反应
①常温下浓硫酸能使铁、铝等金属钝化。②加热时,浓硫酸可以与除铱,钌之外的所有金属(包括金,铂)反应,生成高价金属硫酸盐,本身被还原成SO2,S,H2S或金属硫化物。
Cu 2H2SO4(浓)=加热=CuSO4 SO2↑ 2H2O
(副反应有5Cu 4H2SO4(浓)=加热=3CuSO4 Cu2S 4H2O等)
2Fe 6H2SO4(浓)=加热=Fe2(SO4)3 3SO2↑ 6H2O
Pt 4H2SO4(浓)=加热=Pt(SO4)2 2SO2↑ 4H2O(338℃的沸腾浓硫酸中,腐蚀率0.4mm/年以上;金被腐蚀的速度则慢得多)
在上述反应中,硫酸表现出了强氧化性和酸性。
(2)与非金属反应
热的浓硫酸可将碳、硫、磷等非金属单质氧化到其高价态的氧化物或含氧酸,本身被还原为二氧化硫。在这类反应中,浓硫酸只表现出氧化性。
C 2H2SO4(浓)=加热=CO2↑ 2SO2↑ 2H2O
S H2SO4(浓)=加热=3SO2↑ 2H2O
2P 5H2SO4(浓)=加热=2H3PO4 5SO2↑ 2H2O
(3)与其他还原性物质反应
浓硫酸具有强氧化性,实验室制取硫化氢、溴化氢、碘化氢等还原性气体不能选用浓硫酸。
H2S H2SO4(浓)==S↓ SO2 2H2O
2HBr H2SO4(浓)==Br2 SO2 2H2O
8HI H2SO4(浓)==4I2 H2S 4H2O

稀硫酸特性
性质
- 可与多数金属(比铜活泼)和绝大多数金属氧化物反应,生成相应的硫酸盐和水;
- 可与所含酸根离子对应酸酸性比硫酸根离子弱的盐反应,生成相应的硫酸盐和弱酸;
- 可与碱反应生成相应的硫酸盐和水;
- 可与氢前金属在一定条件下反应,生成相应的硫酸盐和氢气;
- 加热条件下可催化蛋白质、二糖和多糖的水解;
- 能与指示剂作用,使紫色石蕊试液变红,使无色酚酞试液不变色。
- 工业用途
冶金及石油工业
用于冶金工业和金属加工在冶金工业部门,特别是有色金属的生产过程需要使用硫酸。例如用电解法精炼铜、锌、镉、镍时,电解液就需要使用硫酸,某些贵金属的精炼,也需要硫酸来溶解去夹杂的其他金属。在钢铁工业中进行冷轧、冷拔及冲压加工之前,都必须用硫酸清除钢铁表面的氧化铁。在轧制薄板、冷拔无缝钢管和其他质量要求较高的钢材,都必须每轧一次用硫酸洗涤一次。另外,有缝钢管、薄铁皮、铁丝等在进行镀锌之前,都要经过用硫酸进行酸洗。在某些金属机械加工过程中,例如镀镍、镀铬等金属制件,也需用硫酸来洗净表面的锈。在黑色冶金企业部门里,需要酸洗的钢材一般约占钢总产量的5%~6%,而每吨钢材的酸洗,约消费98%的硫酸30~50kg。
用于石油工业汽油、润滑油等石油产品的生产过程中,都需要浓硫酸精炼,以除去其中的含硫化合物和不饱和碳氢化合物。每吨原油精炼需要硫酸约24kg,每吨柴油精炼需要硫酸约31kg。石油工业所使用的活性白土的制备,也消耗不少硫酸。
在浓缩硝酸中,以浓硫酸为脱水剂;氯碱工业中,以浓硫酸来干燥氯气、氯化氢气等;无机盐工业中,如冰晶石、硼砂、磷酸三钠、磷酸氢二钠、硫酸铅(、硫酸锌、硫酸铜、硫酸亚铁以及其他硫酸盐的制备都要用硫酸。许多无机酸如磷酸、硼酸、铬酸(有时也指CrO3)、氢氟酸、氯磺酸;有机酸如草酸、醋酸等的制备,也常需要硫酸作原料。此外炼焦化学工业(用硫酸来同焦炉气中的氨起作用副产硫酸铵)、电镀业、制革业、颜料工业、橡胶工业、造纸工业、油漆工业(有机溶剂的制备)、工业炸药和铅蓄电池制造业等等,都消耗相当数量的硫酸。
可用作硬水的软化剂、离子交换再生剂、pH值调节剂、氧化剂和洗涤剂等。还可用于化肥、农药、染料、颜料、塑料、化纤、炸药以及各种硫酸盐的制造。在石油的炼制、有色金属的冶炼、钢铁的酸洗处理、制革过程以及炼焦业、轻纺业、国防军工都有广泛的应用。强酸性清洗腐蚀剂。在集成电路制造工艺中主要用于硅片清洗。
解决人民衣食住行
用于化学纤维的生产为人民所熟悉的粘胶丝,它需要使用硫酸、硫酸锌、硫酸钠的混合液作为粘胶抽丝的凝固浴。每生产1t粘胶纤维,需要消耗硫酸1.2~1.5t,每生产1t维尼龙短纤维,就要消耗98%硫酸230kg,每生产1t卡普纶单体,需要用1.6t20%发烟硫酸。此外,在尼龙、醋酸纤维、聚丙烯腈纤维等化学纤维生产中,也使用相当数量的硫酸。
用于化学纤维以外的高分子化合物生产塑料等高分子化合物,在国民经济中越来越占有重要的地位。每生产1t环氧树脂,需用硫酸2.68t,号称“塑料王”的聚四氟乙烯,每生产1t,需用硫酸1.32t;有机硅树胶、硅油、丁苯橡胶及丁腈橡胶等的生产,也都要使用硫酸。
用于染料工业几乎没有一种染料(或其中间体)的制备不需使用硫酸。偶氮染料中间体的制备需要进行磺化反应,苯胺染料中间体的制备需要进行硝化反应,两者都需使用大量浓硫酸或发烟硫酸。所以有些染料厂就设有硫酸车间,以配合需要。
用于日用品的生产生产合成洗涤剂需要用发烟硫酸和浓硫酸。塑料的增塑剂(如苯二甲酸酐和苯二甲酸酯)、赛璐珞制品所需的原料硝化棉,都需要硫酸来制备。玻璃纸、羊皮纸的制造,也需要使用硫酸。此外,纺织印染工业、搪瓷工业、小五金工业、肥皂工业、人造香料工业等生产部门,也都需要使用硫酸。
用于制药工业磺胺药物的制备过程中的磺化反应,强力杀菌剂呋喃西林的制备过程中的硝化反应,都需用硫酸。此外,许多抗生素的制备,常用药物如阿斯匹林、咖啡因、维生素B2、维生素B12及维生素C、某些激素、异烟肼、汞溴红、糖精等的制备,无不需用硫酸。
巩固国防
某些国家硫酸工业的发展,曾经是和军用炸药的生产紧密连结在一起的。无论军用炸药(发射药、爆炸药)或工业炸药,大都是以硝基化物或硝酸酯为其主要成分。主要的有硝化棉、三硝基甲苯(TNT)、硝化甘油、苦味酸等。虽然这些化合物的制备是依靠硝酸,但同时必须使用浓硫酸或发烟硫酸。
原子能工业及火箭技术
原子反应堆用的核燃料的生产,反应堆用的钛、铝等合金材料的制备,以及用于制造火箭、超声速喷气飞机和人造卫星的材料的钛合金,都和硫酸有直接或间接的关系。从硼砂制备硼烷的过程需要多量硫酸。硼烷的衍生物是最重要的一种高能燃料。硼烷又用做制备硼氢化铀用来分离铀235的一种原料。 由此可见,硫酸与国防工业和尖端科学技术都有着密切的关系。
- 农业用途
土壤改良
在农业生产中,越来越多地采用硫酸改良高pH值的石灰质土壤。过去20年来,尿素-硫酸肥料的产量大幅度提高并在美国西部诸州的土壤中广泛施用。将硫酸注入牛奶场湖泊,改变湖水pH值,可解决圈养牲畜过程产生的若干空气和水质问题,将硫酸施入农用土壤和水中,其主要作用是溶解钙、镁的碳酸盐和碳酸氢盐。这些钙、镁盐然后取代可交换的钠盐,钠盐随后用水浸洗除去。当碳酸盐和碳酸氢盐被分解后,硫酸与更惰性的物质反应,释放出磷、铁等植物养分。简单地降低土壤的pH值可引起许多元素溶解度的变化,提高它们对植物的效力。在高pH值的石灰质土壤上施用硫酸,可使植物更加健壮,收成增加。
化肥生产
用于肥料的生产硫酸铵(俗称硫铵或肥田粉)和过磷酸钙(俗称过磷酸石灰或普钙)这两种化肥的生产都要消耗大量的硫酸。
用于农药的生产许多农药都要以硫酸为原料如硫酸铜、硫酸锌可作植物的杀菌剂,硫酸铊可作杀鼠剂,硫酸亚铁、硫酸铜可作除莠剂。最普通的杀虫剂,如1059乳剂(45%)和1605乳剂(45%)的生产都需用硫酸。

日常家居用途
世界各地大多数酸性化学通渠用品均含有浓硫酸。这一类的通渠用品就和碱性的通渠用品一样,可以溶解淤塞在渠道里的油污及食物残渣等。不过,由于浓硫酸会与水发生高放热反应,故建议在使用前尽量保持渠道干爽,并慢慢倒入有关化学用品,另需佩戴手套。
储存方法
储存于阴凉、通风的库房。库温不超过35℃,相对湿度不超过85%。保持容器密封。远离火种、热源,工作场所严禁吸烟。远离易燃、可燃物。防止蒸气泄漏到工作场所空气中。避免与还原剂、碱类、碱金属接触。搬运时要轻装轻卸,防止包装及容器损坏。配备相应品种和数量的消防器材及泄漏应急处理设备。倒空的容器可能残留有害物。稀释或制备溶液时,应把酸加入水中,避免沸腾和飞溅伤及人员。
信息由科普中国审核,图片来源网络
,




