
撰文 | 望夜
责编 | 兮
如果要盘点新冠疫情带给生命科学领域的进展,mRNA疫苗正式获批使用一定位列榜首。本次疫情中mRNA疫苗的开发可谓神速,自病毒序列公布到FDA批准紧急授权使用(EUA)仅用时约11个月,凸显其迅捷转化潜力。目前大部分进展到临床的mRNA应用聚焦于传染病和癌症疫苗,这主要由于某些mRNA种类和剂型的固有免疫特征,只需低剂量、低表达水平、局部递送就足以起效。与此同时,mRNA编码的蛋白或细胞免疫疗法也已经起步,此类临床应用要求mRNA仅可引起最小的免疫刺激、可在靶细胞或靶器官中大量表达、需要重复多次给药,对其临床转化带来新的生产和剂型挑战。过去的一年见证了第二代新冠疫苗、Omicron加强针,及针对流感、EBV、HIV和癌症的mRNA疫苗的一系列临床进展。
2022年5月9日,MIT的Daniel G. Anderson课题组在Nature Biotechnology发表题为The clinical progress of mRNA vaccines and immunotherapies的综述文章,回顾mRNA疗法的最新临床进展,总结并展望这种mRNA药物背后的转化技术。BioArt特为读者带来文章的编译。

随着两款mRNA疫苗获批用于新冠病毒预防,mRNA的医学前景已得到充分证明。两款疫苗分别是辉瑞和BioNTech公司的BNT162b2(商品名Comirnity)及Moderna公司的mRNA-1273(商品名Spikevax)。其中后者在2020年3月16日就已开始接种志愿者进行临床试验,彼时距离新冠病毒序列公布日期仅过去数周。当然这些进展背后凝结的是此前长达十年的临床试验铺垫。
使用mRNA编码蛋白作为疫苗或蛋白替换的概念,早在1990年就已进行体内研究验证【1】——经肌肉注射的mRNA在小鼠体内成功表达出目标蛋白。但是随后经过近30年才得以开展临床试验,这种滞后部分源于mRNA稳定性、递送的技术难题,还有研究热度的冷却,自2000年起,更多的资助和产业界兴趣开始转向DNA疫苗【2】。但是,仍有部分专家坚信,凭借mRNA自身在设计和测试中的便捷性和快速实现、非遗传免疫原性、可快速放大和大规模生产、几乎可以忽略的插入突变风险等优势,仍持续推动其研发。
mRNA独特又重要的优势在于可作为蛋白质翻译模板。传统疫苗往往依赖大规模哺乳动物细胞培养或使用大量鸡胚,而mRNA一旦进入患者细胞就可以变为终产物,即,使用人体作为疫苗生成车间。此外,还有如下优势:首先,允许人体对蛋白进行翻译后修饰以降低潜在的免疫原性,但仍带有完整功能。其次,多聚体蛋白在生物反应器中不易生产,但在患者细胞中可以正确地表达、折叠和组装,例如,Moderna设计过一个包含五种mRNA的CMV实验性疫苗(mRNA-1647)可以直接产生五聚体蛋白。第三,mRNA疗法可以产生跨膜蛋白或胞内蛋白,并将其运输至特定的细胞内环境。
相较于病毒载体疫苗,mRNA更不易受预存抗体或给药后抗体(针对病毒载体的抗体)的影响。尽管曾有临床前研究观察到针对RNA纳米载体的抗体产生,消除此类反应的方法也已出现,不会影响后续剂次的效价【3-5】。已有人体多次注射的成功案例【6】或多次注射带有短干扰RNA纳米载体的成功案例【7】。
类似其他药物,mRNA的剂量可以增减,不同剂次的间隔可长可短,取决于病人个体的需求、体重和疾病状态。此外,由于mRNA自身半衰期短,引起不可逆副作用的可能性大为降低,因此可用于治疗急性期疾病。由于mRNA的降解受正常细胞过程的调节,其在体内的半衰期可以通过添加相关修饰或以不同递送方法进行调节。
本综述中,作者广泛介绍了有关mRNA药物的临床应用及进展,重点介绍在生产和剂型中的技术革新,因为这两点决定了mRNA从概念变为获批疫苗。此外,还重点介绍临床实验中的收获及未来研究存在的挑战,及其他药物形式,如mRNA编码的蛋白和细胞免疫疗法。
一、mRNA作为一种医疗产品
mRNA药物可以分成三类:预防性疫苗、治疗性疫苗及蛋白编码疗法。尽管每种应用都有各自挑战,但一个共同点在于如何将mRNA递送到目的细胞并保持mRNA的稳定性。RNA分子原本就不稳定,所以早期概念验证阶段的重点就是提高稳定性。不同技术包括优化5’端帽子结构、3’端poly(A)尾的长度、及5’和3’非编码区的调节元件等【8】。
还有递送技术。十年间,研究者先后尝试过裸mRNA、纳米颗粒包裹,如今更多使用脂质载体递送。典型的脂质纳米载体(LNP)剂型包含如下组成:(1)一个可与多聚负电荷的RNA互作的阴离子或阳离子脂分子层;(2)一个辅助磷脂分子(如DSPC),用于模拟细胞膜中的脂质成分并支持形成双层结构;(3)一种胆固醇类似物,用于调节脂双层的流动性;(4)聚乙二醇-脂质,用于提高胶束稳定性并降低调理作用(图1)。

图1 mRNA脂质纳米颗粒的组成
尽管相较LNP的进展略显滞后,多聚体纳米颗粒(PNP)也已显示出作为递送系统的前景。这种剂型通常由一个生物可降解的、含氨的多聚体组成,可以与RNA发生自组装。根据应用不同,PNP中可加入辅助磷脂、胆固醇和PEG-脂。LNP和PNP都可进一步修饰特殊基团以增强其细胞靶向性。这类非病毒型的载体组成差别各异,对递送效率的影响各不相同,也会影响细胞靶向性及免疫原性。
激发合适的免疫反应是剂型选择中需要着重考虑的一环。RNA自身就是一个激活天然免疫的强效底物,无论作为RNA病毒的遗传物质,还是DNA病毒复制过程中的副产物。微生物来源的RNA因其结构和序列特征,可被宿主细胞的模式识别受体识别。主要有两类模式识别受体通过与其匹配的天然免疫反应产生I型干扰素(IFN)和炎症细胞因子:一类是Toll样受体(TLR),位于表皮细胞和DC、单核、巨噬等免疫细胞的细胞膜、内体和溶酶体;另一类是视黄酸诱导基因I(RIG-I)样受体,位于大多数细胞的胞浆中。TLR3被双链RNA(dsRNA)激活,而TLR7和TLR8则被单链RNA激活。RIG-I和黑色素瘤分化相关蛋白5(MDA5)分别被胞浆中5’磷酸化的短dsRNA(18-19bp)和长dsRNA(>1000bp)激活【9】。TLR3激活导致IFN-I的产生,是通过TICAM-1通路;而其他TLRs利用MYD88依赖的级联反应诱导转录因子NF-κB依赖或IRF3依赖的的炎性细胞因子前体的产生。上述通路被激活的程度,在一定程度上决定了一款mRNA产品的应用和发展前景。
mRNA的生物医疗应用场景仍在扩展。以下将从三方面讨论——传染病的预防性mRNA疫苗、癌症的治疗性mRNA疫苗、由mRNA编码的免疫疗法。
二、 传染病疫苗
mRNA作为疫苗的关键优势在于其免疫激活能力和可作为免疫佐剂的能力,但成为一款真正在临床使用的安全有效的产品,还要平衡免疫激活与目的抗原表达。到目前为止,最成功的产品都是非复制性mRNA疫苗,带有化学修饰的或未修饰的核酸碱基。目前获批的两款mRNA产品BNT162b2和mRNA-1273都带有化学修饰的尿嘧啶。
而未修饰的mRNA新冠疫苗尚无成功案例。CureVac宣称其未修饰新冠疫苗(CVnCOV)仅显示47%的保护效果【10】,并将原因归于流行毒株的变化;另有观点认为CureVac所用剂量较低(12μg),而BNT162b2使用30μg,mRNA-1732使用100μg。选择这样的剂量是因为未修饰的RNA反应活性更高,但实际使用中可能不足以产生足够的中和抗体;也有观点认为未修饰的RNA翻译效率低,导致表位少。
除上述非复制性mRNA疫苗,也有研究组在探索自我扩增型构建,其mRNA可编码RNA依赖的RNA聚合酶,用于RNA扩增,因此可以增加抗原蛋白的表达【4】。目前该类疫苗仅完成早期临床试验。其需要递送的mRNA分子量较大,可能是一个缺点。
与重组蛋白疫苗类似,上述mRNA疫苗不会产生感染性颗粒,因而不会像减毒疫苗和复制缺陷型病毒疫苗可能转变为致病型,也不会引起疾病加重(如某款RSV减毒疫苗)。而较于DNA疫苗或某些病毒载体疫苗,mRNA也不存在由于整合到宿主基因组而引起的潜在插入突变风险。
2.1 快速发现和开发
新冠疫情的全球快速传播要求疫苗开发加速,mRNA疫苗的速度已经得到充分展现:当第一剂mRNA疫苗开始临床测试时,病毒感染或接种DNA疫苗可以为非人灵长类中提供免疫保护效果的报道尚未发表。让我们再次回顾一下本次史无前例的开发速度(图2)——辉瑞-BioNTech和Moderna独立而又几乎同速完成疫苗开发进程,将一款疫苗的开发时间由之前的数年,缩短到如今约11个月(从基因序列公布到获得EUA)。
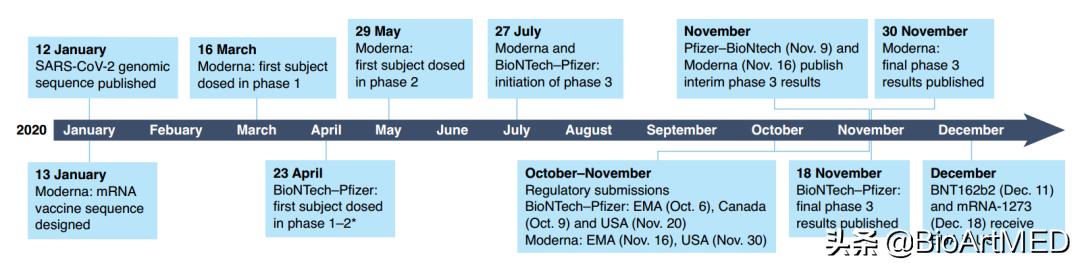
图2 两款mRNA新冠疫苗的开发时间
其他公司也正在加速推进各自管线。CureVac在2020年6月宣布获许开展CVnCOV的I期临床试验,并在一年后公布其II/III期临床的中期数据;Arcturus在2020年11月9号宣布其I期临床的中期结果;赛诺菲巴斯德、伦敦皇家学院、云南Walvax也都在新冠序列公布一年之内开启各自mRNA疫苗的临床试验。
COVID-19大流行给传统疫苗开发带来挑战,也为mRNA疫苗研究提供独特环境。而来自生物医学高级研究与发展局和流行病预防创新联盟的巨量资助无疑也十分关键。公共卫生应急机制推动研究进入快速档,并促进各大制造商找到缩短临床前用时的方法,例如,平行推进开发过程中的不同环节,最小化模块研究,进行最小量的产品质量控制放行测试。而验证mRNA疫苗技术与传统疫苗优劣的大量研究则被置于较低的优先级。
2.2 生产及放大
mRNA的一大优势在于易于放大,类似某些DNA疫苗类型。因为全过程基本都在体外进行,使用化学方法。mRNA本身编码目标抗原,无需活病毒,因此不需要特殊的生物安全车间;相较于利用鸡胚生产的疫苗,mRNA疫苗无需受鸡胚产能和逐一接种的限制。无细胞体系生产可将细菌污染风险降至最低,且无需使用生物反应器。
全核酸疫苗,不论是mRNA或是DNA,均编码免疫原,而其自身不依赖于该抗原。不同mRNA疫苗的生产使用相同的化学组分,这意味着一次投入,后续可用于不同病原的疫苗生产,这对突发病原或季节性疫苗的生产商尤其具有吸引力。此外,相同的生产过程不但可用于疫苗生成,也可用于mRNA药物的生产,高效而灵活。鉴于新冠病毒变异株不断出现,在第一代mRNA疫苗生产的同时,可以灵活地转变mRNA序列但采用同样的递送载体。尽管目前对mRNA的生成成本说法不一,普遍认为其性价比高于传统方法【11】。
2.3 抗原特异的快速序列优化
mRNA技术的另一优势在于序列的设计或再设计,即引入不同的核苷酸,这比蛋白或多肽的工程化改造更加直接。对新冠疫苗而言,最突出的例子就是通过在序列中引入脯氨酸使S蛋白维持在融合前构象从而稳定其免疫原性。
利用这一优势,BioNTech公司开发出不少于5种mRNA候选疫苗(三种带有核苷酸修饰,一种mRNA带有尿嘧啶,及一种自扩增型mRNA)并推进到临床阶段,其中候选疫苗株BNT162b1使用带有修饰核苷酸的mRNA编码S蛋白的受体结合区,为增强免疫原性还引入一个T4纤维蛋白来源的三聚体折叠结构域【12】;而最终选定的BNT162b2编码全长S蛋白,并带有两个脯氨酸突变以将其锁定在融合前构象【13】。其他诸如CureVac、Moderna、Translate Bio公司的mRNA新冠疫苗也都在S蛋白上引入不同的改造。
一些正在开发中的mRNA疫苗也都经过迭代优化,这是mRNA产品的又一大特征。例如,靶向RSV的mRNA-1777已进行I期临床试验,通过一次注射后的中和抗体水平反映体液免疫反应【14】,但该药物的开发进程因mRNA-1172而暂停,因为后者在动物水平显示出更强效果【15】。类似的例子还有寨卡病毒候选疫苗株mRNA-1325的开发因mRNA-1893而暂停【15】,后者序列不同,在非人灵长动物试验中有效性高20倍。截止2020年2月,已有90位受试者接种mRNA-1893或安慰剂,受试者包含血清阳性和阴性的,已接种第一针(一个月后接种第二针),测试剂量包括10、30、100 μg。
2.4 编码多种蛋白和/或蛋白亚基
新冠病毒S蛋白是一个同源三聚体,因此仅需引入单一mRNA序列。但某些病原的免疫原可能由多种亚基构成,不难想象使用重组蛋白方式的挑战,需要构建各亚基并成功组装成一个具有正确亚基数目的完整蛋白。而mRNA可以轻松应对这一困难,不同亚基或者通过一条长多肽链编码或者分别使用不同mRNA链编码。例如,CMV候选疫苗mRNA-1647包含6条mRNA,其中5条编码5种不同的亚基共同构成五聚体蛋白,第六条编码CMV的糖蛋白gB【15】。此外,还有利用一款疫苗应对两种不同病原的策略,包含两条mRNA链即可,如mRNA-1653就含有两条mRNA链,分别靶向人类偏肺病毒(hMPV)和副流感病毒亚型3(PIV3)的F蛋白【15】。
2.5 调节mRNA免疫原性
除通过序列迭代进行抗原的免疫原性优化,RNA产品生产过程中产生的固有免疫原性也可用于增强mRNA的免疫反应。这是RNA疫苗的一种优势,因为可以激活免疫反应通路(如TLR系统),诱导DC成熟及后续的B、T细胞强免疫反应。当然,这种免疫激活作用也可能是有害的,导致严重的临床副反应,例如,RNA依赖的蛋白激酶R(PKR)的活化就被认为会抑制翻译【16】。
近年来,在体调节mRNA免疫原性已经取得一些进展,最主要的方法是用化学修饰替换非修饰核苷酸。某些核苷酸修饰,如假尿嘧啶和5’-甲基胞嘧啶,可以显著降低TLR信号和PKR活化,增加蛋白在小鼠中的表达量【16-17】。前述两种新冠mRNA疫苗都使用N1-甲基假尿嘧啶替换尿嘧啶。但也有研究显示,相较于带有修饰碱基的mRNA,未修饰的构建在Hela细胞及小鼠肝脏中的蛋白表达量更高【18】。作者推测mRNA纯化方法的改进和杂质RNA的去除或许可以部分解释上述报道中的差异。使用凝胶柱纯化祛除dsRNA或新近出现的更廉价的膜结合技术均可显著提高翻译效率【19-20】。CureVac的研究人员报道经HPLC纯化、序列优化、含有非修饰碱基的mRNA无免疫原性并可在小鼠体内表达更多的目的蛋白【21】。近期,Genetech的科学家报道白介素(IL)-1β和IL-1受体激动剂(IL-1RA)是调节mRNA系统响应的关键调节子【22】,这提示可能是小鼠、非人灵长类、人体中这类调节元素的差异导致研究结果不同。
2.6 mRNA递送的纳米制剂
早期,mRNA递送使用的是裸mRNA或鱼精蛋白,随着技术进步转向使用LNPs递送。一款早期狂犬疫苗(CV7201)曾使用鱼精蛋白,但免疫原性因接种方式不同存在差异(仅无针头的皮下注射可以提供理想的免疫反应【23】),其开发中断;转而采用LNPs递送候选疫苗株CV7202【24】。无独有偶,采用裸mRNA的iHIVARNA-01是一款联合TriMix(三种mRNA分别编码TLR4、CD40配体和CD70)和HIV抗原的候选疫苗,曾在临床测试过安全性和有效性,但由于缺乏免疫原性而中止。
目前进入临床的mRNA药物大多使用LNPs递送。FDA批准的第一款基于RNA的寡核苷酸药物patisiran(一段短的干扰RNA用于治疗前白蛋白介导的遗传性淀粉样沉淀神经病(TTR))使用的就是LNP剂型,包含一种可电离脂质、d-Lin-MC3-DMA (MC3)、DSPC、胆固醇和PEG2000-DMG【25】。BioNTech的BNT162b2采用的是ALC-0315、ALC-0315、DSPC和胆固醇。目前看来,发现、测试和生产合适的剂型决定了mRNA产品进入临床的速度。例如mRNA-1273使用mRNA-1647(CMV病毒疫苗)和mRNA-1653(hMPV-PIV2病毒疫苗)相同的LNP,其某些临床和管理惯例已经建立好(表1)。

表1 曾/正进行临床II/III期试验的mRNA传染病疫苗
LNP的组成对胞内递送效率有重要影响,决定递送的细胞特异性并调节其免疫原性。在各种脂质组成中,可电离脂质的作用尤其受到重视,因其在递送中发挥多重功能,包括颗粒形成、细胞吸收和内吞体逃逸。可电离脂的结构差异巨大,为快速合成和评价,目前已建立起联合的高通量方法,合成大容量的新脂质库并评估其体内效果【26-29】。可用于在体递送mRNA的可电离脂不断涌现,可以兼顾递送效率和耐受性【30-32】。尽管目前脂质的开发趋势仍以引入可水解键(利于清除)为主,但可降解键可能会影响制剂的稳定性,仍然是LNPs制剂开发中的挑战。冻干似乎可以增加mRNA-LNPs的稳定性,但在低剂量应用场景(如疫苗)中,抗水解脂质可能更有优势。
除全身系统递送外,RNA制剂在其他疾病的治疗中也有应用潜力,如神经系统【33】、眼部【34-35】,心脏【36-37】和肺部【38-41】。需要特别指出的是,基于可降解多聚物【39】、寡聚物【40】和脂质【41】的纳米制剂已可通过雾化方式促进肺上皮细胞递送。例如,患有囊性纤维肿的患者已接受两剂MRT5005,就是通过雾化方式给予的LNP包裹的编码囊性纤维膜调节蛋白的mRNA。
2.7 储存和运输
制剂开发的另一重要方面是存储和运输条件。在2014-2016年埃博拉疫情期间,维持疫苗的冷链运输和储存的重要性就已凸显,彼时一款基于减毒重组VSV的实验疫苗需要存储在-80℃~-60℃,但在最需要疫苗的非洲地区往往难以保证。COVID-19席卷全球,从全球应急响应的角度,亟需将数以百万剂的疫苗运输到世界各地,地区间医疗基础设施差别巨大,温度条件也各不相同。据报道,CureVac的CVnCoV在5℃下可稳定保持至少3个月,即便在室温下也可维持24小时。Moderna的mRNA-1273可在-20℃保存最多6个月,冰箱冷藏30天或室温下12小时。BioNTech的疫苗最初需要保存在-70℃,其合作商辉瑞开发出一个特殊的干冰运输装置,使其可在冰箱中保存2周【42】。
首次进行人体试验时,通常仅有少量受试者和有限的测试点,采用的往往是非最优剂型,随着临床试验的进展,保存条件也在优化。例如,Moderna的mRNA-1647在I期临床中使用的是冷冻液体制剂,但在II期临床时就改用冻干剂型,可在冰箱中稳定保存18个月。
运输、保存和稳定性的重要性在mRNA-1443的开发中体现得尤为突出,这款疫苗靶向CMV的磷酸蛋白65T抗原。它与mRNA-1647采用相同的临床试验测试,但临床用材料在保存1年后未能达到内部规范,这款疫苗的测试似乎因此而中断【43】。
将试剂制成干粉是运输和长期储存中最常用的手段,但过程中的结晶和真空脱水可能影响制剂的稳定性,出现活性降低等情况。加入适当的冷冻保护剂,如海藻糖、蔗糖、甘露醇,据称可以保持其稳定性。辉瑞已启动旨在测试冻干型BNT162b2稳定性和耐受性的III期临床试验。
2.8 接种方式
何为最佳接种方式目前尚无定论,尽管批准的两款新冠mRNA疫苗都采用肌肉注射。为在全球开展疫苗接种,最好采用无需对广大医护工作者再培训的方式。BTN162b2、CVnCoV、ARCT-021及mRNA-1273都采取肌肉注射。伦敦皇家学院的研究者计划研究吸入式自扩增mRNA疫苗,类似季节性流感疫苗【44】。吸入或滴鼻疫苗可以同时产生细胞和体液免疫,尤其适于呼吸道病毒预防,如新冠病毒。但滴鼻mRNA疫苗的研究受限于临床前动物模型【45】,随着LNP载体的继续开发有望实现对上呼吸道特定靶细胞的高效递送。
在更广泛的mRNA赛道上,候选疫苗的接种方式既有皮下也有肌肉注射,也有疫苗在同一试验中同时使用上述两种方式。两种接种方式产生的效果迥异,包括免疫原性和耐受性。mRNA-1440编码H10N8亚型流感病毒血凝素(HA)蛋白,其I期临床同时采用肌肉(25-400 μg)和皮下(25-50 μg)注射接种。皮下注射导致更多的接种点反应,甚至25μg剂量都无法继续进行;而接受400μg剂量肌肉注射的三位受试者中的两位出现严重的副反应(头疼和红斑),安全委员会因此中止该剂量的后续测试【15,46】。如前所述,狂犬疫苗CV7201仅在无针刺系统接种时才能产生免疫效果,也测试过皮下和肌肉接种两种方式【23】。iHIVARNA-01似乎是目前唯一一款滴鼻给药的疫苗【47】。类似蛋白和DNA疫苗,肌肉注射也是现阶段传染病mRNA疫苗最经常采用的接种方式。
2.9 剂量方案
最理想的剂量方案是一次免疫后迅速产生100%的血清转换,尤其在大流行期间。但由于存在免疫增强现象,大多数疫苗的免疫至少接种两次,通常间隔数周,新冠mRNA亦如是:BNT162b2两针间隔21天,CVnCOV和mRNA-1273的间隔为4周。BNT162b2和mRNA-1273的接种方案均已获得EUA。由于一次免疫后即可产生部分保护效果,在疫情初期疫苗紧缺时,有人呼吁与其保证少数人的两次接种不如在大范围人群中仅接种一剂【48】,或者延长两剂的间隔时间。80岁以上人群中的小范围临床数据显示,BNT162b2两剂间隔3个月的免疫效果优于间隔3周,评估指标是抗体产生峰值,但未涉及细胞免疫数据【49】。与此同时,越来越多的证据显示接种第三针可产生更好的保护效果。最近数据显示疫苗接种6个月后保护效果开始减弱【50】,而新变异株的出现又加剧了紧迫性。
自扩增型mRNA疫苗(如ARC-021和BNT162c2)设计的单剂免疫。剂量设计更加精细的研究也已出现,例如预防CMV的mRNA-1647在I期临床试验中,设置了30、90、180、300μg剂量(mRNA-1647或安慰剂),分别在0、2、6个月注射三次【15】。正在进行I期临床的RSV疫苗mRNA-1345也设计三次免疫,分别间隔2个月,目前正以单次剂量进行临床III期试验。
尽管技术和抗原选择类似,开发中的新冠病毒mRNA疫苗剂量范围很广。基于所用技术,自扩增型mRNA疫苗每一剂的用量较少:皇家学院的自扩增疫苗测试剂量介于0.1-1 μg。ARCT-021曾测试1-10 μg剂量,分别设计单剂或免疫-增强两种方式,现已选定7.5μg用于后续开发。BNT162b2在30μg和mRNA-1273在100μg剂量下可以分别减少95%的新冠感染病例【51-53】。CVnCOV正在进行临床III期测试,采用12μg剂量。新冠之外的赛道中,剂量使用范围更广,差异可达300倍,从1μg(CV7202)到300μg(mRNA-1653和mRNA-1657)【15】。目前看来,最有影响力的新冠或未来大流行病毒的疫苗未必是第一个获得EUA授权的,更可能是第一个具备百万剂产量并可有效分发到终端的疫苗。
2.10 佐剂的作用
如前所述,mRNA具有固有的免疫激活特性。作为免疫激活的补充或替代,有研究组在疫苗中添加刺激分子,促进mRNA编码抗原的免疫原性。例如,CureVac的CV8102是一段非编码、不含帽子结构的单链RNA,混合一段阳离子多肽载体用于增强一款狂犬疫苗的免疫原性【54-55】。CureVac的RNAative疫苗技术平台依赖双组分mRNA疫苗,裸mRNA用于编码抗原,另一个相同的mRNA混合鱼精蛋白作为佐剂,激活TLR7和TLR8信号通路【56-57】。TLR信号通路的激活随后活化DC,作为响应鱼精蛋白复合物的天然免疫反应的一部分。另一款产品iHAVARNA-01同时含有激活DC的mRNA分子(编码TriMix)及一条编码HIV免疫原的mRNA【58】。
但mRNA疫苗很少添加佐剂。BNT162b2和mRNA-1273仅依赖mRNA-LNP制剂而不使用佐剂,目前正在开发mRNA的公司大多选择无佐剂方法,这可能因为LNP组分本身即可刺激免疫系统中的某些组分,如IFN-γ(STING)通路刺激物和TLR-RIG-I样受体非依赖媒介子。纳米制剂既可将mRNA递送至特定靶细胞,又可根据设计选择性刺激免疫系统,是mRNA作为疫苗平台的一大优势。
2.11 副作用事件
由于是预防性制剂,传染病疫苗的安全性和耐受性要求更高。在本综述中讨论的mRNA疫苗的安全性评估与蛋白类疫苗一致。局部注射疼痛、局部或系统性炎症反应(发热、不适)是最经常出现的副反应【15、23、46】。两款mRNA疫苗曾接种超过30万健康志愿者(包括老年人),是评估副反应谱的最佳数据库,但在进行数据比较时应注意实际使用中存在三种不同剂量。此外,由于测试过程排除了某些最高风险的受试者(如曾有过敏史的),未必能代表全部人群。两款疫苗的临床III期试验中,超过80%的受试者报告局部副反应,主要是疼痛。系统性事件主要是头疼、疲劳、体温升高、肌痛和关节痛【51】。对mRNA-1273,副作用的发生频率和严重程度似乎在第二剂接种时最明显【51】。尚不清楚mRNA和LNP对上述副作用起多大作用,因为在III期临床中使用的安慰剂是盐溶液,而非裸mRNA或空LNPs。第二剂疫苗接种后副作用严重程度增加可能源于反应原性增加,类似现象在mRNA-1647的临床II期测试中也出现,这款CMV疫苗同时接种给CMV阳性和阴性的受试者,两组受试者的安全性评估未见差异,但在第二次接种后出现副作用频发和略微加重的趋势。
即便像新冠mRNA疫苗这类大型临床试验,也未必能发现某些极罕见但又有潜在危害的副作用事件。疫苗接种数天至数周后,年轻男性中报告出现心肌炎也促使FDA的免疫接种咨询委员会重新评估新冠疫苗的收益和风险。据计算,年轻男性人群患心肌炎的风险最高(每百万剂接种中,12-29岁年龄组预计出现39-47次),但收益远超风险(减少11000例感染,1139例重症及6例死亡)【60】。
三、癌症的治疗性疫苗
近期,癌症免疫治疗爆火,促使研究者将mRNA技术向该方向应用【61】(表2)。mRNA应用于癌症免疫治疗的方法之一,是表达缺陷或改造的抑癌蛋白对免疫抑制的肿瘤微环境进行修饰。但目前的mRNA递送形式不太可能覆盖病人的所有癌细胞。事实上,更多的关注点是将mRNA作为治疗性疫苗,训练免疫系统发现并杀死癌细胞。mRNA疫苗成功对抗新冠和其他传染病的关键特性也奠定其作为癌症疫苗的基础,包括快速开发和生产,及可编码完整抗原。此外,许多肿瘤病人已对现有免疫靶向药物产生抗性,这也为mRNA产品提供新机遇。

表2 曾/正进行临床II/III期试验的mRNA癌症疫苗
无论何种方式的治疗性癌症疫苗开发都面临一系列挑战。不同于预防性疫苗通过体液免疫实现保护性效果,治疗性肿瘤疫苗必须确保产生强效的细胞毒CD8 细胞反应,以清除癌变细胞。尽管预防性肿瘤疫苗也是可行的,但目前FDA仅批准两款预防性肿瘤相关疫苗,均由病毒(HPV和HBV)感染引起。选择合适的抗原以产生肿瘤高特异性的免疫反应是另一大挑战,因为不同个体中抗原差异巨大。为此,目前的趋势是开发病人特异的新抗原。最后的挑战来自肿瘤微环境的免疫抑制作用,阻止T细胞浸润肿瘤并导致T细胞耗竭。因此,治疗性癌症疫苗需要与克服肿瘤微环境的疗法联用,如免疫检查点抑制剂(如前述BNT111)【62】。
3.1 肿瘤相关抗原(TAA)
TAA选择性表达在肿瘤细胞表面,是免疫系统杀伤肿瘤细胞的靶标。靶向TAA的癌症疫苗涉及一系列固定的TAA用以应对不同肿瘤。该类疫苗进度最快的是BNT111,包含四种黑色素瘤相关抗原(NY-ESO-1、酪氨酸酶、MAGE A3、TPTE),正在进行临床I-II期试验,测试单用或联用免疫检查点抑制剂的效果。这款疫苗通过静脉注射接种,首先连续注射8次,随后每月追加一次注射,目前与cemiplimab联用的方案已进展至II期临床。BNT111临床试验免疫的部分结果已经发表【6】:编码四种TAA的mRNA需要进行优化以促进在非成熟DC细胞中的翻译,每条序列都带有一段信号肽、破伤风毒素的CD4 表位P2和P16、及MHC I类分子运输结构域,用于增强HLA呈递和免疫激活。50位受试者中的75%至少表现出对一种TAA的IFN-γ响应。抗原特异性T细胞表型为OD1 CCR7−DD27 /−D45RA−效应记忆型,刺激后分泌IFN-γ和肿瘤坏死因子。在持续接受疫苗接种的患者中,TAA特异细胞保持稳定;而停用维持接种的患者,T细胞仍可存在数月,随后开始下降。对黑色素瘤的杀伤能力是通过离体测试的,向健康供者的CD8 细胞转染TAA特异性T细胞受体,评估其裂解黑色素瘤的能力。每一剂接种后,病人血清中IFN-α、IFN-γ、IL-6及其他细胞因子的水平升高,接种数小时后达到峰值,24小时恢复正常。副作用事件同期出现,主要是轻度到中度的流感样症状,都是瞬时且自限的。最初评价的42位病人经影像学评估效果喜人:在仅接受该疗法的25位患者中,3位出现部分响应,7位出现稳定响应;而在疫苗-抗PD1联合治疗组的17位患者中,6位出现部分响应。最有意思的结果出现在两位经抗PD1疗法失败的患者,接受疫苗疗法后又出现对抗PD1疗法的响应,这与观察到的疫苗诱导产生PD1 T细胞相一致。BNT111目前正在进行黑色素瘤II期临床试验【63】。
mRNA-5671(V941)是一款多联体,用于向免疫系统展示KRAS抗原,包括四种最常见的KRAS替代物(G12D、G12V、G13D、G12C)【15】,目前正在进行I期临床试验,测试单用或与pembrolizumab联用。此外,还有BNT112(编码5种前列腺癌特异抗原)、BNT113(编码HPV16来源的肿瘤抗原E6和E7,即病毒的原癌蛋白)、BNT114(编码多种选定的乳腺癌抗原)及BNT115(编码三种卵巢癌TAA)。
CureVac使用未修饰mRNA链编码TAA并已开展早期试验,包括使用自体扩增的肿瘤裸mRNA作为免疫疗法方案【64】,裸mRNA编码6种肾癌相关抗原【65】,鱼精蛋白稳定的mRNA编码6种不同的黑色素瘤相关抗原【66】。上述研究主要考察设计的安全性和耐受性。其他涉及肿瘤相关抗原的研究还包括:CV9103(编码四种前列腺癌抗原)【67】、CV9104(6条mRNA分别编码6种不同的前列腺抗原)【68】、CV9201(编码5种非小细胞肺癌抗原)【69】。但上述项目似乎都已中止【24】,仅CV9202尚处于活跃状态,采用6条mRNA链分别编码六种抗原(NY-ESO-1、MAGE C1、MAGE C2、TPBG(5T4)、生存素及黏蛋白-1)【70】。
3.2 个性化抗原
在癌变过程中,恶性细胞突变后会表达一些正常细胞中不存在的蛋白。这些蛋白被蛋白酶体处理成多肽后递呈到细胞表面结合MHC I类受体,并被T细胞受体所识别。这些新抗原通常是病人特异的,这就为肿瘤特异和病人特异的免疫疗法带来机遇和挑战。
为获得病人特异新抗原的mRNA疫苗,肿瘤被切除并利用二代测序鉴定出其中病人特异的新抗原。编码这些新抗原的mRNA随后被注射回该病人体内,以诱导免疫反应攻击病人肿瘤。要尽量缩短操作时间,以使病人在癌变进展前获得治疗,整个周期据称可缩短至30-40天【71】。这也给生产环节提出新的挑战,因为必须满足人用研究产品的技术指标。
目前,个性化新抗原疫苗大多是多肽疫苗而非mRNA疫苗,而且很难成功。最适宜接种此种疗法的是那些突变种类最高的肿瘤,但这类肿瘤也最易产生耐药性。与多肽疫苗相比,作者推测mRNA编码的新抗原疫苗或许可以提供更强的免疫反应和临床收益,因其具备更适宜的免疫刺激。mRNA可以编码整个抗原蛋白,递呈多种表位,而无需受限于多肽疫苗中特定的HLA表位【72】。此外,mRNA可同时表达多种抗原,用多条mRNA链或集中在同一条链。某些肿瘤类型会产生数十种新抗原,从诱发更广泛免疫反应的角度,也应当表达多种表位以唤醒T细胞反应。
BioNTech已开发出多款临床新抗原候选疫苗株用于肿瘤治疗:经腹股沟淋巴结反复接种,BNT121已在13位病人中测试对转移性黑色素瘤的效果【73】。研究结果令人振奋,可产生足够强的免疫反应并获得某些临床活性证据。BNT122包含多达20种个性化的新抗原,采用静脉滴注,正在进行四项研究(表2)。初步结果显示,BNT122单用或与PD-L1抗体ztezolizumab联用时,安全性处于可接受范围,副作用大都是短期的,如滴注相关反应和/或细胞因子释放综合征(发热、体寒)。此外,BNT122还在进行前列腺癌的I期临床试验,即将开展对非小细胞肺癌的试验,以及一项尚未公开的辅助治疗。
另一款个性化癌症疫苗mRNA-4157包含34种新抗原,由同一条mRNA链编码(新抗原多联体),通过LNP递送,肌肉注射。该药物正在进行I期临床试验,包括对切除后原发固体肿瘤的单一治疗及对转移性未切除肿瘤的治疗。截止2020年2月,共有71位患者至少接种过一剂mRNA-4157【15】。最常出现的副作用是疲劳、接种处疼痛、结肠炎和肌痛。同时,mRNA-4157还作为pembrolizumab的辅助用于治疗高风险黑色素瘤,正在进行II期临床试验【15】。
借助患者特异的mRNA序列的快速应用,mRNA-LNP平台的灵活和速度优势在新抗原疫苗中得以体现。此外,多种接种方式(如瘤内注射、淋巴节注射、静脉滴注、肌肉注射)都值得尝试,同种LNP制剂可采用不止一种接种方式。这使得一种候选疫苗的应用潜力更广:直接瘤内注射不可行或注射部位不靠近淋巴节时,可以选择静脉或肌肉注射相应mRNA疫苗。挑战在于发现最有效的蛋白或蛋白组合,促使免疫系统攻击癌细胞,促进免疫系统深入到肿瘤组织内部,并为每一位患者设计个性化的疗法。
四、蛋白和细胞疗法中的应用
最近,mRNA的应用研究领域重燃对免疫蛋白或免疫调节蛋白(如抗体或细胞因子)疗法的兴趣(图3)。与传染病和癌症疫苗相比,这类应用场景要求的蛋白表达量更高,某些甚至需要终生治疗。

表3 曾/正进行临床II/III期试验的mRNA蛋白替代疗法
蛋白免疫疗法的另一挑战是递送,将mRNA送至靶器官或特定细胞类型以达到最佳治疗效果。例如,某些蛋白需要额外的翻译后修饰,如糖基化和蛋白裂解过程,以获得完整功能。但是,翻译后修饰往往是组织特异性的,可能无法由mRNA序列本身直接实现,凸显出组织特异性递送的必要性。
当mRNA与LNPs系统给药时,多数选择归巢至肝脏,这是由于LNP表面结合的载脂蛋白E导致受体依赖的干细胞吸收。非肝脏器官选择可通过对脂质组分的修饰实现,包括调整脂质比例和一致性,产生靶向非内皮或肾脏的LNP。最近,LNP表面化学修饰PEG-脂结构使其可以靶向造血干细胞处的骨髓内皮细胞【73】。
故,mRNA蛋白免疫疗法面临递送、表现效率和耐受性等几大挑战,这或许是该应用方向进度滞后的原因。
4.1 mRNA编码的单克隆抗体疗法
如何将mRNA经注射直接递送至特定组织或器官是开发的主要障碍,系统给药可以大大简化临床应用,只要过程是安全的且产生足够量的蛋白获得治疗效果。编码单克隆抗体(mAb)就是mRNA的应用之一,如mRNA-1944编码一种病人体内分离到的基孔肯雅病毒中和抗体【74】。健康志愿者中的初步结果显示,在各个剂量(静脉注射0.1、0.3、0.6 mg/kg)下均可检出中和抗体表达。但在最高剂量时,4位受试者中的3位出现注射处反应,其中一位患者出现三级心动过速和白细胞升高,二级恶心、呕吐、发热和动态心电图T波倒置【75】。另一个队列使用相同的剂量,并预先使用类固醇类,未出现三级副反应事件,但抗体水平降低1.7倍【76】。0.3mg/kg剂量接种两次(间隔两周)的队列数据显示,第二次接种后副作用未加重且无脂质聚积【76】。
使用mRNA生产抗体一直受到研究的关注,一些工业合作正在进行中,如CureVac与Genmab的合作(mRNA编码抗体用于抗癌疗法),Neurimmune和Ethris的合作(吸入式mRNA编码新冠单抗),这是基于生产等量的抗体使用mRNA编码的性价比高于传统重组方法的判断。最具前景的方法应当是一个有关剂量、作用时间、PTM类型、递送系统和目标抗体的相对治疗指数的函数。
4.2 mRNA编码免疫刺激蛋白用于癌症治疗
编码具有直接治疗效果的蛋白是mRNA抗癌疗法的另一种选择,如OX40配体(OX40L)或者白介素,可激活免疫系统。mRNA-2416就是此类产品,其mRNA编码免疫检查点调节子OX40L,经瘤内注射给药。最初单独使用时,41位患者的数据未能达到实体瘤疗效评价指标,现在与durvalumab联用治疗卵巢癌,正在进行II期临床试验。
还有一些mRNA产品编码数种不同的免疫调节蛋白,如ECI-006,包含TriMix(编码DC活化分子CD40L、CD70、caTLR4)及编码黑色素瘤特异TAA(酪氨酸酶、gp100、MAGE A3、MAGE C2、PRAME)的mRNA【77】。目前正在I期临床试验,治疗切除后的黑色素瘤【78】。另一个例子是mRNA-2752,三条mRNA分别编码OX40L、IL-23和IL-36γ,目前正在进行剂量测试,治疗实体瘤和淋巴瘤。此外还有BNT131,编码IL-12sc、IL-15sushi、IFN-α和GM-CSF,正在测试瘤内注射是否可以改变肿瘤微环境【71】。
另一类产品表达免疫调节融合蛋白,如MEDI1191,编码一个单链融合蛋白,包含IL-12α和IL-12β亚基,两者由linker连接,采用瘤内注射以提高耐受性【15】。
4.3 mRNA在过继免疫疗法中的应用
过继细胞转输是一种相对新颖的治疗方法,涉及收集病人自身免疫细胞治疗自身肿瘤。该方法已在乳腺癌患者中试验过,通过向瘤内注射转化有编码嵌合抗原受体(CAR)的mRNA的T细胞,耐受性良好,可在肿瘤组织内诱导产生炎症反应【79】。4位患者接受自身T细胞治疗间皮瘤,其中电转入编码鼠源单抗CAR的mRNA【80】。其中一位受试者在第三次输入后数分钟内出现过敏反应和心脏骤停,作者将其归因于人体中IgE的产生。更近期,转化编码靶向间皮素CAR的mRNA的T细胞已用于治疗前列腺癌,其临床I期研究中未出现细胞因子释放综合征,也未出现神经系统症状。
CAR-T细胞曾通过逆转录病毒基因转移产生,并取得实质性进展。近期引入CRISRP-Cas9介导的基因整合系统,而使用mRNA和核蛋白介导递送的成功案例也已出现。正如前面讨论的,需要关注CAR T细胞在体内产生的潜力。尽管核蛋白的体内功能性递送尚未报道,最终mRNA应比病毒递送更具优势,表现在装载能力、反复给药、安全性、有效递送等多方面。
纳米制剂有利于促进在体递送至多种类型的免疫细胞,包括巨噬细胞、B细胞、T细胞,因此在多种免疫疗法中极具前景。例如,通过靶向T细胞的mRNA递送,可以实现在体的CAR T细胞生成,从而为癌症治疗创造出新的疗法类型【81】。对LNP修饰特定脂结构,可使其重定向T细胞。而且,抗体靶向的mRNA纳米颗粒可以获得免疫细胞特定受体的亲和力,如CD4【82】。
mRNA可以提供(基因组编辑)核酸酶或碱基编辑器的瞬时表达,用于免疫细胞的在体编辑,随着RNA的降解表达很快终止。尽管到目前为止,mRNA仅在体外实现对T细胞中绿色荧光蛋白信号的破坏【83】,通过系统性递送mRNA对肝细胞进行基因编辑,已在人体中用于治疗TTR淀粉样变性,其mRNA编码的是Cas9蛋白,与一条靶向TTR的gRNA一起由LNP递送。病人血液中的TTR蛋白浓度出现剂量依赖的降低,仅出现轻微的副作用,这一积极结果显示出mRNA在系统性基因编辑中的应用潜力。
五、 结论和展望
mRNA在基因疗法和蛋白疗法间开辟出一个独特的位置,具有多种优势,同时也面临诸多挑战。相较于多聚体蛋白的生物反应器生产中难以克服的技术问题,通过一条或多条mRNA可在病人体内自行产生目的蛋白,其灵活性已经在CMV疫苗、癌症疫苗开发中初露峥嵘。当前,新冠病毒突变株不断涌现,对疫苗设计灵活的需求更加迫切。随着技术的发展,mRNA的未来应用不会仅限于传染病和癌症治疗。
mRNA疗法表达的目标蛋白持续时间短,特别适于应用在仅需表达一种或少数几种蛋白的场景,如传染病疫苗。通过反复给药、调整剂量和间隔时间,可使其应用于病人的个性化治疗。从安全性的角度看,在两款疫苗(mRNA-1273和mRNA-1647)测试中,曾出现较为明显的副作用,尤其在第二剂注射后。癌症疫苗BNT111已经在病人中使用,需要注射8次以上,疗效十分稳定。吸入式mRNA疗法MRT5005连续五周给药,安全性并未随着注射次数增加而变严重。
随着工程化改造的人工蛋白的构建,mRNA疗法的潜力还将进一步扩展。在蛋白疗法中,可通过工程化改造(如融合Fc结构域)延长半衰期。mRNA疗法也可借鉴类似策略。或许在未来胞内疗法实现时,结果会更令人振奋。mRNA瞬时表达基因编辑器似乎可以减轻持续性表达产生的副作用。此外,胞内表达的抗体、抗体片段或蛋白结合基序可以提供一种崭新的治疗策略,如通过结合亚细胞定位结构域定位至核内,以提高编码蛋白的效果。
mRNA的最初应用涉及免疫系统的刺激,无论是传染病疫苗还是癌症疫苗。传染病疫苗已迈出成功第一步,癌症疫苗方向尚无特别成功的案例,但BNT111的初步结果提示,通过结合高蛋白表达量和免疫激活通路可以克服早期蛋白疫苗遇到的某些技术瓶颈。
RNA自身固有的免疫激活能力使其应用更具优势,且不依赖于编码序列,例如CV8102就是作为佐剂的非编码RNA,其免疫刺激特征的确定是在回顾mRNA候选药物临床安全性和耐受性中发现的。mRNA类药物最频繁出现的副反应是炎症反应,如肌肉或皮下注射中的局部反应(局部疼痛、红肿、酸痛),而静脉、肌肉或吸入式接种更经常出现发热综合征或流感样症状。上述症状可通过抗炎药物进行治疗,如前述mRNA编码基孔肯雅单抗的试验中,预先使用类固醇可有效缓解副作用。该方法成功缓解副作用,但也带来蛋白表达量降低的问题。
上面的例子为mRNA的未来应用提出新的思路:类固醇类是否可有效消除炎症副反应且是必需的?如果是,代价是否是蛋白表达量降低?更进一步,低蛋白表达量带来副反应减少的现象是否暗示一定水平的炎症反应是理想蛋白表达量的前提?若果真如此,临床试验中就应该允许出现一定程度的炎症反应以保证足够的目标蛋白产量,但又不至于威胁到重复给药时个体的承受能力。
但多数mRNA产品使用的并非裸mRNA,而是包裹于LNP或PNP中,它们均会影响耐受性,这使问题更加复杂化。有研究者提出应在临床中使用空LNP作对照,评估mRNA和LNP对耐受性的贡献率。但当不含mRNA时,空LNP的理化特征会改变,参考价值存疑。尽管在单剂疫苗注射或致病性疾病治疗中瞬时的炎症反应是可以接受的,但在需要长期治疗的应用中,尤其静脉滴注时,应尽可能选择耐受性好、安全的脂质和剂型。动物实验在此过程中参考价值十分有限:癌症疫苗BNT111在人体中引起的细胞因子释放比小鼠中低1000倍以上【6】,而吸入式MRT5005引起的发热症状在动物毒性实验中未曾出现。
此外,脂质聚积也是一个长期存在的问题。如果产生的蛋白半衰期短,剂次间隔会很短,导致脂质来不及清除,在目标组织内部或其他组织中聚积,其长期风险无法预测。因此,未来的mRNA疗法研究中,制剂科学的重要性等同于mRNA生物学研究。
mRNA疗法非凡的潜力还在于不同的给药途径:肌肉注射、皮内注射、皮下注射、淋巴节内注射、瘤内注射、静脉滴注、心内注射、吸入式。此外,还可探索其他给药方式,如滴鼻、眼内或鼻内液滴、皮肤软膏、栓剂、膀胱灌注装置、颅内注射。作者认为mRNA疗法将受益于递送纳米颗粒,越来越多的证据显示LNP和PNP可经工程化改造递送至特定体内组织,包括肝脏、内皮、肺部、骨髓、免疫系统。递送效率和组织靶向性的提高、更多可递送目标的出现,无疑会促进mRNA疗法的进一步发展。
两款新冠疫苗的成功获批凸显出mRNA在临床转化中的速度优势。得益于初期在个性化新抗原的快速发现和转化中的探索,新冠序列公布数周内mRNA疫苗就进展至临床试验。而新冠疫苗的应用又暴露出对冷链运输储存的依赖。-80℃冰箱是专业化设备,很难普及;而某些需要患者自己注射的疗法,甚至-20℃储存都难以保证。这再次说明,制剂科学是保证mRNA由试验台到临床的关键。
本次新冠疫情中,mRNA疫苗的成功引起全世界的关注,无论其mRNA-LNP的优势还是劣势。当公众仍聚焦在两款疫苗的生产速度、储存条件、副作用时,科研和医学界的目光早已越过它们,热切期待更多应用场景的实现。
原文链接:
https://www.nature.com/articles/s41587-022-01294-2
制版人:十一
参考文献
1、 Wolf, J. A. et al. Direct gene transfer into mouse muscle in vivo. Science 247, 1465–1468 (1990).
2、 Kutzler, M. A. & Weiner, D. B. DNA vaccines: ready for prime time? Nat. Rev. Genet. 9, 776–788 (2008).
3、 Sabnis, S. et al. A novel amino lipid series for mRNA delivery: improved endosomal escape and sustained pharmacology and safety in non-human primates. Mol. Ter. 26, 1509–1519 (2018).
4、 Chahal, J. S. et al. Dendrimer-RNA nanoparticles generate protective immunity against lethal Ebola, H1N1 infuenza, and Toxoplasma gondii challenges with a single dose. Proc. Natl Acad. Sci. USA 113, E4133–4142 (2016).
5、 Besin, G. et al. Accelerated blood clearance of lipid nanoparticles entails a biphasic humoral response of B-1 followed by B-2 lymphocytes to distinct antigenic moieties. Immunohorizons 3, 282–293 (2019).
6、 Sahin, U. et al. An RNA vaccine drives immunity in checkpoint-inhibitor-treated melanoma. Nature 585, 107–112 (2020).
7、 Adams, D. et al. Patisiran, an RNAi therapeutic, for hereditary transthyretin amyloidosis. N. Engl. J. Med. 379, 11–21 (2018).
8、 Pardi, N., Hogan, M. J., Porter, F. W. & Weissman, D. mRNA vaccines—a new era in vaccinology. Nat. Rev. Drug Discov. 17, 261–279 (2018).
9、 Tatematsu, M., Funami, K., Seya, T. & Matsumoto, M. Extracellular RNA sensing by pattern recognition receptors. J. Innate Immun. 10, 398–406 (2018).
10、 CureVac. CureVac Provides Update on Phase 2b/3 Trial of First-Generation COVID-19 Vaccine Candidate, CVnCoV https://www.curevac.com/en/2021/06/16/curevac-provides-update-on-phase-2b-3-trial-of-frst-generation-covid-19-vaccine-candidate-cvncov/ (2021).
11、 Kis, Z., Shattock, R., Shah, N. & Kontoravdi, C. Emerging technologies for low-cost, rapid vaccine manufacture. Biotechnol. J. 14, e1800376 (2019).
12、 Mulligan, M. J. et al. Phase I/II study of COVID-19 RNA vaccine BNT162b1 in adults. Nature 586, 589–593 (2020).
13、 Walsh, E. E. et al. Safety and immunogenicity of two RNA-based COVID-19 vaccine candidates. N. Engl. J. Med. 383, 2439–2450 (2020).
14、 Aliprantis, A. O. et al. A phase 1, randomized, placebo-controlled study to evaluate the safety and immunogenicity of an mRNA-based RSV prefusion F protein vaccine in healthy younger and older adults. Hum. Vaccin. Immunother. 17, 1248–1261 (2020).
15、 Moderna, Inc. United States Securities and Exchange Commission Form 10-K (2020).
16、 Anderson, B. R. et al. Incorporation of pseudouridine into mRNA enhances translation by diminishing PKR activation. Nucleic Acids Res. 38, 5884–5892 (2010).
17、 Karikó, K., Buckstein, M., Ni, H. & Weissman, D. Suppression of RNA recognition by Toll-like receptors: the impact of nucleoside modification and the evolutionary origin of RNA. Immunity 23, 165–175 (2005).
18、 Kaufman, K. J. et al. Efficacy and immunogenicity of unmodified and pseudouridine-modified mRNA delivered systemically with lipid nanoparticles in vivo. Biomaterials 109, 78–87 (2016).
19、 Kariko, K., Muramatsu, H., Ludwig, J. & Weissman, D. Generating the optimal mRNA for therapy: HPLC purification eliminates immune activation and improves translation of nucleoside-modified, protein-encoding mRNA. Nucleic Acids Res. 39, e142 (2011).
20、 Baiersdörfer, M. et al. A facile method for the removal of dsRNA contaminant from in vitro-transcribed mRNA. Mol. Ter. Nucleic Acids 15, 26–35 (2019).
21、 Tess, A. et al. Sequence-engineered mRNA without chemical nucleoside modifications enables an effective protein therapy in large animals. Mol. Ter. 23, 1456–1464 (2015).
22、 Tahtinen, S. et al. IL-1 and IL-1ra are key regulators of the inflammatory response to RNA vaccines. Nat. Immunol. 23, 532–542 (2022).
23、 Alberer, M. et al. Safety and immunogenicity of a mRNA rabies vaccine in healthy adults: an open-label, non-randomised, prospective, first-in-human phase 1 clinical trial. Lancet 390, 1511–1520 (2017).
24、 CureVac. CureVac B.V. Securities and Exchange Commission Filing https://sec.report/Document/0001104659-20-086354/tm2016252-11_f1.htm (2020).
25、 Zhang, X., Goel, V. & Robbie, G. J. Pharmacokinetics of patisiran, the first approved RNA interference therapy in patients with hereditary transthyretin-mediated amyloidosis. J. Clin. Pharmacol. 60, 573–585 (2019).
26、 Akinc, A. et al. A combinatorial library of lipid-like materials for delivery of RNAi therapeutics. Nat. Biotechnol. 26, 561–569 (2008).
27、 Love, K. T. et al. Lipid-like materials for low-dose, in vivo gene silencing. Proc. Natl Acad. Sci. USA 107, 1864–1869 (2010).
28、 Dong, Y. et al. Lipopeptide nanoparticles for potent and selective siRNA delivery in rodents and nonhuman primates. Proc. Natl Acad. Sci. USA 111, 3955–3960 (2014).
29、 Whitehead, K. A. et al. Degradable lipid nanoparticles with predictable in vivo siRNA delivery activity. Nat. Commun. 5, 4277 (2014).
30、 Fenton, O. S. et al. Bioinspired alkenyl amino alcohol ionizable lipid materials for highly potent in vivo mRNA delivery. Adv. Mater. 28, 2939–2943 (2016).
31、 Maier, M. A. et al. Biodegradable lipids enabling rapidly eliminated lipid nanoparticles for systemic delivery of RNAi therapeutics. Mol. Ter. 21, 1570–1578 (2013).
32. Hassett, K. J. et al. Optimization of lipid nanoparticles for intramuscular administration of mRNA vaccines. Mol. Ter. Nucleic Acids 15, 1–11 (2019).
33、 Nabhan, J. F. et al. Intrathecal delivery of frataxin mRNA encapsulated in lipid nanoparticles to dorsal root ganglia as a potential therapeutic for Friedreich’s ataxia. Sci. Rep. 6, 20019 (2016).
34、 Patel, S., Ryals, R. C., Weller, K. K., Pennesi, M. E. & Sahay, G. Lipid nanoparticles for delivery of messenger RNA to the back of the eye. J. Control. Release 303, 91–100 (2019).
35、 Lewin, A. S. et al. The effects of PEGylation on LNP based mRNA delivery to the eye. PLoS ONE 15, e0241006 (2020).
36、 Turnbull, I. C. et al. Myocardial delivery of lipidoid nanoparticle carrying modRNA induces rapid and transient expression. Mol. Ter. 24, 66–75 (2016).
37、 Anttila, V. et al. Synthetic mRNA encoding VEGF-A in patients undergoing coronary artery bypass grafting: design of a phase 2a clinical trial. Mol. Ter. Methods Clin. Dev. 18, 464–472 (2020).
38、 Sahu, I., Haque, A. K. M. A., Weidensee, B., Weinmann, P. & Kormann, M. S. D. Recent developments in mRNA-based protein supplementation therapy to target lung diseases. Mol. Ter. 27, 803–823 (2019).
39、 Patel, A. K. et al. Inhaled nanoformulated mRNA polyplexes for protein production in lung epithelium. Adv. Mater. 31, e1805116 (2019).
40、 Lokugamage, M. P. et al. Optimization of lipid nanoparticles for the delivery of nebulized therapeutic mRNA to the lungs. Nat. Biomed. Eng. 5, 1059–1068 (2021).
41、 DeRosa, F., Heartlein, M. & Karve, S. Ice-Based Lipid Nanoparticle Formulation for Delivery of mRNA https://patents.google.com/patent/US20200155691A1/ (2020).
42、 Pfizer. Pfizer and BioNTech Submit COVID-19 Vaccine Stability Data at Standard Freezer Temperature to the U.S. FDA https://www.pfzer.com/news/press-release/press-release-detail/pfzer-and-biontech-submit-covid-19-vaccine-stability-data (2021).
43、 Moderna, Inc. United States Securities and Exchange Commission Form S-1 (2018).
44、 O’Hare, R. Landmark coronavirus study to trial inhaled Imperial and Oxford vaccines. Imperial News Imperial College London https://www.imperial.ac.uk/news/203653/
45、 Lorenzi, J. C. C. et al. Intranasal vaccination with messenger RNA as a new approach in gene therapy: use against tuberculosis. BMC Biotechnology 10, 77 (2010).
46、 Feldman, R. A. et al. mRNA vaccines against H10N8 and H7N9 influenza viruses of pandemic potential are immunogenic and well tolerated in healthy adults in phase 1 randomized clinical trials. Vaccine 37, 3326–3334 (2019).
47、 Leal, L. et al. Phase I clinical trial of an intranodally administered mRNA-based therapeutic vaccine against HIV-1 infection. AIDS 32, 2533–2545 (2018).
48、 Tomas, K. U.S. COVID vaccine supply: how to make sense of those confusing numbers. The New York Times. https://www.nytimes.
49、 Parry, H. et al. Extended interval BNT162b2 vaccination enhances peak antibody generation. NPJ Vaccines 7, 14 (2022).
50、 Tomas, S. J. et al. Safety and efficacy of the BNT162b2 mRNA COVID-19 vaccine through 6 months. N. Engl. J. Med. 385, 1761–1773 (2021).
51、 Baden, L. R. et al. Efficacy and safety of the mRNA-1273 SARS-CoV-2 vaccine. N. Engl. J. Med. 384, 403–416 (2021).
52、 Polack, F. P. et al. Safety and efficacy of the BNT162b2 mRNA COVID-19 vaccine. N. Engl. J. Med. 383, 2603–2615 (2020).
53、 Pfizer. Pfizer and BioNTech Conclude Phase 3 Study of COVID-19 Vaccine Candidate, Meeting All Primary Efficacy Endpoints https://www.pfizer.com/news/press-release/press-release-detail/pfizer-and-biontech-conclude-phase-3-study-covid-19-vaccine (2020).
54、 Doener, F. et al. RNA-based adjuvant CV8102 enhances the immunogenicity of a licensed rabies vaccine in a first-in-human trial. Vaccine 37, 1819–1826 (2019).
55、 Eigentler, T., Krauss, J. & Schriber, J. Intratumoral RNA-based TLR-7/-8 and RIG-I agonist CV8102 alone and in combination with anti-PD-1 in a phase I dose-escalation and expansion trial in patients with advanced solid tumors. Cancer Res. 79, LB-021 (2019).
56、 Kallen, K. J. et al. A novel, disruptive vaccination technology: self-adjuvanted RNActive® vaccines. Hum. Vaccin. Immunother. 9, 2263–2276 (2013).
57、 Rauch, S., Lutz, J., Kowalczyk, A., Schlake, T. & Heidenreich, R. RNActive® technology: generation and testing of stable and immunogenic mRNA vaccines. Methods Mol. Biol. 1499, 89–107 (2017).
58、 de Jong, W. et al. iHIVARNA phase IIa, a randomized, placebo-controlled, double-blinded trial to evaluate the safety and immunogenicity of iHIVARNA-01 in chronically HIV-infected patients under stable combined antiretroviral therapy. Trials 20, 361 (2019).
60、 Gargano, J. W. et al. Use of mRNA COVID-19 vaccine after reports of myocarditis among vaccine recipients: update from the advisory committee on immunization practices—United States, June 2021. Morb. Mortal. Wkly Rep. 70, 977–982 (2021).
61、 Mortezaee, K. Immune escape: a critical hallmark in solid tumors. Life Sci. 258, 118110 (2020).
62、 Zahm, C. D., Moseman, J. E., Delmastro, L. E. & Mcneel, D. G. PD-1 and LAG-3 blockade improve anti-tumor vaccine efficacy. Oncoimmunology 10, 1912892 (2021).
63、 BioNTech SE. United States Securities and Exchange Commission Form F-1 https://investors.biontech.de/node/8126/html (2020).
64、 Weide, B. et al. Results of the first phase I/II clinical vaccination trial with direct injection of mRNA. J. Immunother. 31, 180–188 (2008).
65、 Rittig, S. M. et al. Intradermal vaccinations with RNA coding for TAA generate CD8 and CD4 immune responses and induce clinical benefit in vaccinated patients. Mol. Ter. 19, 990–999 (2011).
66、 Weide, B. et al. Direct injection of protamine-protected mRNA: results of a phase 1/2 vaccination trial in metastatic melanoma patients. J. Immunother. 32, 498–507 (2009).
67、 Kubler, H. et al. Self-adjuvanted mRNA vaccination in advanced prostate cancer patients: a first-in-man phase I/IIa study. J. Immunother. Cancer 3, 26 (2015).
68、 Rausch, S., Schwentner, C., Stenzl, A. & Bedke, J. mRNA vaccine CV9103 and CV9104 for the treatment of prostate cancer. Hum. Vaccin. Immunother. 10, 3146–3152 (2014).
69、 Sebastian, M. et al. A phase I/IIa study of the mRNA-based cancer immunotherapy CV9201 in patients with stage IIIB/IV non-small cell lung cancer. Cancer Immunol. Immunother. 68, 799–812 (2019).
70、 Papachristoflou, A. et al. Phase Ib evaluation of a self-adjuvanted protamine formulated mRNA-based active cancer immunotherapy, BI1361849 (CV9202), combined with local radiation treatment in patients with stage IV non-small cell lung cancer. J. Immunother. Cancer 7, 38 (2019).
71、 BioNTech. Securities and Exchange Commission Filing https://www.sec.gov/Archives/edgar/data/1776985/000119312520022991/d838504df1.htm (2020).
72、 Diken, M., Kranz, L. M., Kreiter, S. & Sahin, U. mRNA: a versatile molecule for cancer vaccines. Curr. Issues Mol. Biol. 22, 113–128 (2017).
73、 Krohn-Grimberghe, M. et al. Nanoparticle-encapsulated siRNAs for gene silencing in the haematopoietic stem-cell niche. Nat. Biomed. Eng. 4, 1076–1089 (2020).
74、 Wadhwa, A., Aljabbari, A., Lokras, A., Foged, C. & Takur, A. Opportunities and challenges in the delivery of mRNA-based vaccines. Pharmaceutics 12, 102 (2020).
75、 Moderna. Moderna Announces Positive Phase 1 Results for the First Systemic Messenger RNA Therapeutic Encoding a Secreted Protein (mRNA-1944) https://investors.modernatx.com/news-releases/news-release-details/moderna-announces-positive-phase-1-results-frst-systemic (2019).
76、 Moderna. Annual R&D Day https://investors.modernatx.com/events-andpresentations/events/event-details/2020/RD-Day/default.aspx (2020).
77、 Fernandez, A. M. A. et al. A phase I study (E011-MEL) of a TriMix-based mRNA immunotherapy (ECI-006) in resected melanoma patients: analysis of safety and immunogenicity. J. Clin. Oncol. 37, 2641 (2019)
78、 Liang, X., Li, D., Leng, S. & Zhu, X. RNA-based pharmacotherapy for tumors: from bench to clinic and back. Biomed. Pharmacother. 125, 109997 (2020).
79、 Tchou, J. et al. Safety and efficacy of intratumoral injections of chimeric antigen receptor (CAR) T cells in metastatic breast cancer. Cancer Immunol. Res. 5, 1152–1161 (2017).
80、 Maus, M. V. et al. T cells expressing chimeric antigen receptors can cause anaphylaxis in humans. Cancer Immunol. Res. 1, 26–31 (2013).
81、 Parayath, N. N., Stephan, S. B., Koehne, A. L., Nelson, P. S. & Stephan, M. T. In vitro-transcribed antigen receptor mRNA nanocarriers for transient expression in circulating T cells in vivo. Nat. Commun. 11, 6080 (2020).
82、 Tombácz, I. et al. Highly efficient CD4 T cell targeting and genetic recombination using engineered CD4 cell-homing mRNA–LNPs. Mol. Ter. 29, 3293–3304 (2021).
83、 McKinlay, C. J., Benner, N. L., Haabeth, O. A., Waymouth, R. M. & Wender, P. A. Enhanced mRNA delivery into lymphocytes enabled by lipid-varied libraries of charge-altering releasable transporters. Proc. Natl Acad. Sci. USA 115, E5859–E5866 (2018).
(可上下滑动阅览)
转载须知
【原创文章】BioArt原创文章,欢迎个人转发分享,未经允许禁止转载,所刊登的所有作品的著作权均为BioArt所拥有。BioArt保留所有法定权利,违者必究。
,





