一、测定空气中氧气成分的实验
1、实验原理:
在一个密闭的容器中,用一种足量的易燃的物质(如:红磷或白磷)与容器中的氧气反应,生成一种固体,燃烧停止,温度降到室温时,瓶内气压减小,如果将其打开与外界相连且一端伸入盛水烧杯中导管上的止水夹,烧杯中的水在大气压强的作用下,流入密闭容器内,进入的水的体积,填补消耗掉的氧气的体积。

文字表达式:磷(P) 氧气(O2)五氧化二磷(P2O5)
2、实验现象:
红磷剧烈燃烧,黄色火焰,放热,有大量白烟产生;待集气瓶冷却后,打开止水夹,集气瓶内液面上升约1/5体积。
3、注意事项:
① 点燃红磷前要检查装置的气密性
② 红磷要过量(或足量)
③ 点燃红磷前要夹紧止水夹
④ 当燃烧停止,温度接近室温时再打开止水夹
⑤ 不能用碳、硫、蜡烛来代替红磷,因为它们燃烧后都有气体生成。使瓶内气体的体积几乎没有变化,瓶内外气压差很小,水不能进入或进入的水很少,但如果在瓶内先放入能与生成气体反应的物质除去该气体,也能用碳、硫、蜡烛等代替红磷
⑥ 不能用镁代替红磷,因镁也能与氮气反应,使测得的氧气体积比实际偏大
4、对做完实验后水量的分析
(1)吸入瓶内的水不足1/5的原因分析
① 红磷量太少,消耗O2太少。
② 气密性差,漏气。
③ 装置没有冷却到室温就打开了止水夹
(2)吸入瓶内的水大于1/5的原因分析
① 点燃的红磷插入集气瓶时赶跑了瓶内的一部分空气
② 点燃红磷前未夹紧止水夹,使瓶内的空气沿导管跑出
③ 可能选用了能与氮气反应的物质,如:镁等。
5、实验结论:
说明空气不是单一的物质;氧气约占空气总体积的1/5。
6、实验结论延伸
该实验除证明空气中O2的体积量约为空气体积的1/5外,还可得到以下结论。
① 氮气体积含量约占空气体积的4/5:空气主要由O2和N2组成,因为实验测得空气中的O2约占空气体积的1/5,则剩余气体体积基本为N2。
② 氮气不支持红磷燃烧:红磷在瓶内燃烧消耗大部分O2后熄灭,剩下的N2并不能支持红磷继续燃烧。
③ 氮气本身也不能燃烧:燃着的红磷伸入瓶中,若N2也能燃烧,则可能出现瓶内的水上升超过1/5。
④ 氮气不易溶于水:实验中红磷开始燃烧时,瓶内压强增大,实验结束后瓶内压强降低,水被吸入瓶内。这中间,N2都充分与水接触,若N2易溶于水,则瓶内的水的上升可能超过1/5。
氧气知识点1:氧气的物理性质
1. 在通常状况下氧气是无色、无味的气体;
2. 比空气略重;
3. 不易溶于水;
4.
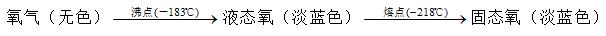
知识点2:氧气的化学性质
1、镁条与氧气的反应

现象:剧烈燃烧,发出耀眼强光 放出热量生成大量白烟
文字表达式:镁 氧气 点燃 氧化镁
2、红磷在氧气中燃烧

现象:剧烈燃烧,发出黄色火焰 放出热量 生成大量白烟
文字表达式:红磷 氧气 点燃 五氧化二磷
3、木炭与氧气反应

现象:在空气中 保持红热 在氧气中 剧烈燃烧,发出白光 放出热量 产生使澄清石灰水变浑浊的气体
文字表达式:碳 氧气 点燃 二氧化碳
4、硫与氧气反应

现象:在空气中 发出微弱的淡蓝色火焰 在氧气中剧烈燃烧,发出明亮的蓝紫色火焰 放出热量 产生有刺激性气味的气体
文字表达式:硫 氧气 点燃 二氧化硫
5、铁丝与氧气反应

现象:在空气中不能燃烧,在氧气中剧烈燃烧,火星四射,放出热量,生成黑色固体(Fe3O4)
文字表达式:铁 氧气 点燃 四氧化三铁
【讨论】物质在空气中燃烧与在氧气中燃烧现象一样吗?这说明了什么?
【总结】1、物质在空气中燃烧主要是与空气中的氧气反应,反应的剧烈程度取决于氧气的含量,氧气含量越高(浓),燃烧越剧烈。
2、物质燃烧时有的有火焰,有的会发光,有的会冒烟。一般来说,气体燃烧会有火焰产生;固体直接燃烧产生光或火星;生成物有固体,一般都会产生烟。
知识点3:化合反应、氧化反应
1、化合反应:(1)定义:由两种或两种以上的物质生成另一种物质的反应。
(2)特点:“多变一” A B→AB
2、氧化反应:物质跟氧发生的反应。
实验室制取氧气知识点1:氧气的工业制法:
工业制法(分离液态空气法)
(1)具体过程


知识点2:实验室制取氧气
反应原理:

1、高猛酸钾制氧气

实验步骤:
①仪器组装:先下后上,从左到右的顺序。
②气密性检查:将导管的一端浸入水槽中,用手紧握试管外壁,若水中的导管口有气泡冒出,证明装置不漏气。松开手后,导管口出现一段水柱。
③ 装入药品:按粉末状固体取用的方法(药匙或纸槽)。试管口要放一小团棉花
④ 加热药品:先使试管均匀受热,后在反应物部位用酒精灯外焰由前向后加热。
⑤收集气体:若用排水集气法收集气体,当气泡均匀冒出时再收集
⑥检验及验满:用带火星的木条伸入试管中,发现木条复燃,说明是氧气;用带火星的木条靠近集气瓶口部,木条复燃,证明已满。
⑦撤出导气管后再熄灭酒精灯
⑧整理仪器
可简单归纳为:“茶(查)、庄(装)、定、点、收、利(离)、息(熄)”
注意事项:
① 试管口要略微向下倾斜:防止水倒流,使试管底部破裂。
② 导气管伸入发生装置内要稍露出橡皮塞:有利于产生的气体排出。
③ 试管口塞一团棉花:防止高锰酸钾粉末进入导气管,污染制取的气体和水槽中的水。
④ 排气法收集气体时,导气管要伸入到接近集气瓶底部:有利于集气瓶内空气排出,使收集的气体更纯。
排水法收集时,等瓶子里的水排完以后,在水面下用玻璃片盖住瓶口。小心地把瓶子移出水槽,正放在桌子上。
⑤ 实验结束后,先将导气管移出水面,然后熄灭酒精灯:防止水槽中的水倒流,炸裂试管。
2、双氧水(过氧化氢)制取氧气

注意事项:
①分液漏斗可以用长颈漏斗代替,但其下端应该深入液面以下,防止生成的气体从长颈漏斗中逸出;
②导管只需略微伸入试管塞
③气密性检查:用止水夹关闭,打开分液漏斗活塞,向漏斗中加入水,水面不持续下降,就说明气密性良好。
④装药品时,先装固体后装液体
⑤该装置的优点:可以控制反应的开始与结束,可以随时添加液体。
分子和原子知识点1:分子和原子
一)认识分子
1、分子的概念:
保持物质化学性质的最小粒子
2、分子的基本性质
(1)分子是构成物质的一种粒子,其质量、体积都非常小。
(2)分子在不断地做无规则运动。

(3)分子之间有一定的间隔:气态>液态>固态
(4)同种分子的化学性质相同;不同种分子的化学性质不同
3、应用分子的观点认识:
(1)纯净物、混合物:

由分子构成的物质中,由同一种分子构成的是纯净物。如冰、水共存物实际为纯净物,因为其中的构成粒子只有一种——水分子,由不同种分子构成的是混合物,如红磷和白磷的混合体为混合物,区分纯净物和混合物的关键是把握“物质的种类”或“分子的种类”是否相同。
(2)物理变化、化学变化
水蒸发是发生了物理变化,而水分解是发生了化学变化
水蒸发时,水分子本身没有变化,变化的只是分子间的间隔。水的化学性质也没有改变。水分解时,水分子变成了氢分子和氧分子。分子变了,生成的氢分子和氧分子不具有水分子的化学性质。
注意:在化学变化中,分子的组成一定改变,分子的数目可能改变。

二)认识原子
1、原子定义:
化学变化中的最小微粒
2、化学反应的实质:
化学变化中分子分裂成原子,原子重新组合成新分子。
3、分子、原子的主要区别:
在化学反应中,分子可分,原子不可分
4、分子、原子的相互关系:

5、原子的基本性质:
(1)原子也是构成物质的一种粒子,其质量、体积都非常小。
(2)原子同分子一样,也是时刻不停地做高速的无规则运动。
温度越高,能量越大,运动速度就越快。
(3)原子之间也有一定的间隔
知识点2:原子的构成
一)构成原子的粒子



在原子里:核电荷数=质子数=核外电子数=元素序号,原子不显电性。
二)相对原子质量
国际上是以一种碳原子(碳12,其原子核内有6个质子和6个中子)的质量的1/12作为标准,其他原子的质量跟它相比较所得的数值,就是这种原子的相对原子质量。

1、相对原子质量是一个比值,不是原子的实际质量。

2、原子的质量主要集中在原子核上,相对原子质量≈质子数+中子数
元素知识点1:元素
一)元素概念:具有相同核电荷数(即质子数)的同一类原子的总称
1、元素概念三要素:
①具有相同核电荷数②同一类原子③总称。
2、元素的种类决定于原子的核电荷数(即核内质子数)。
二)原子和元素的区别与
原子
元素
区别
1. 粒子(成员)
2. 既讲种类,又讲个数
3. 从微观角度描述分子的构成或物质的构成
1、 粒子的总称(集体)
2. 只讲种类,不讲个数
3. 从宏观角度描述物质的组成
联系
元素的概念建立在原子的基础上,原子的核电荷数(即核内的质子数)决定元素的种类
相似
化学反应前后元素和原子的种类都不会改变
☆描述物质:
(1)宏观组成(2)微观构成
以“水H2O”为例:宏观—水由氢元素和氧元素组成
微观—
① 物质由微粒直接构成:水由水分子直接构成
② 分子由原子构成:水分子由氢原子、氧原子构成
③ 一个水分子由2个氢原子和1个氧原子构成(一个水分子共由3个原子构成)
☆从原子的角度认识单质、化合物、氧化物
单质:
(1)宏观:由一种元素组成的纯净物
(2)微观:由一种原子构成的分子或原子
化合物:
(1)宏观:由不同种元素组成的纯净物
(2)微观:由不同种原子构成的一种分子
氧化物:
(1)宏观:由两种元素组成,其中一种是氧元素的化合物
(2)微观:由两种原子构成,其中一种是氧原子的一种分子
三)原子、分子、元素、物质间的联系

四)元素之最:
1、地壳中含量列前四位的元素(质量分数):氧、硅、铝、铁,其中含量最多的元素(非金属元素)是氧,含量最多的金属元素是铝。
2、生物细胞中含量列前四位的元素:氧、碳、氢、氮。
3、大气中含量最多的元素是:氮元素。
,




