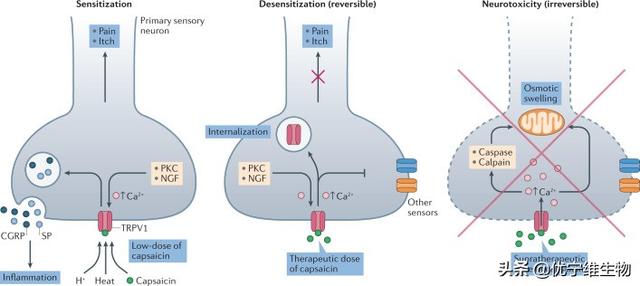
TRPM8是一种钙离子通透的非选择性阳离子通道,属于瞬时受体电位通道超家族。TRPM8在人体中作为冷觉感受器,可以被15-28°C的低温激活,也可以被薄荷醇、冰素(icilin)和PI(4, 5)P2等配体激活。TRPM8已被证实与奥沙利铂或神经损伤导致的冷觉痛相关,也是偏头痛和炎症相关冷超敏反应的潜在治疗靶点。
近年来,研究人员报道了两种鸟类的TRPM8(FaTRPM8,PmTRPM8)在apo状态下以及激动剂或抑制剂结合状态下的冷冻电镜结构,揭示了TRPM8通道的整体结构和配体结合位点。但这两种鸟类的TRPM8结构与已知的TRPM家族其他成员的结构存在显著的差异。鸟类TRPM8的结构特征在哺乳动物中是否具有普适性以及TRPM8的冷激活和配体激活机制仍不清楚。
2022年6月3日,浙江大学基础医学院郭江涛/杨帆课题组在Nature Communications上在线发表了题为“Structures of a Mammalian TRPM8 in Closed State”的研究论文,报道了小鼠TRPM8(MmTRPM8)通道在apo状态、钙离子以及icilin结合状态下的6个高分辨率冷冻电镜结构。
研究人员首先解析了MmTRPM8在apo状态下的冷冻电镜结构。TRPM8通道是一个同源四聚体,每个亚基包含N端的4个TRPM同源重复结构域(MHR1–4),6个跨膜螺旋(TMD,S1–S6),TRP螺旋和C端的coiled-coil结构(图1a,b)。该结构首次揭示了apo状态下完整的TRPM8通道孔区结构域(包括S5,pore helix,selectivity filter,outer pore loop和S6),为解释TRPM8对钙离子的通透性提供了结构基础(图1c,d)。
其次,钙离子和icilin结合状态下的MmTRPM8结构清楚地揭示了钙离子和icilin的结合模式。钙离子结合在类电压感受结构域(VSLD),不直接与icilin相互作用,而是通过起配位氨基酸Asp802与Arg842的相互作用,促进icilin与MmTRPM8的结合(图1e,f,g)。
最后,本研究通过离子孔道半径的计算和结构比较,证实本研究中解析的MmTRPM8的结构均处于关闭状态(图1h),并探讨了MmTRPM8和鸟类TRPM8构象差异的原因,为TRPM8配体门控机制提供了新见解。
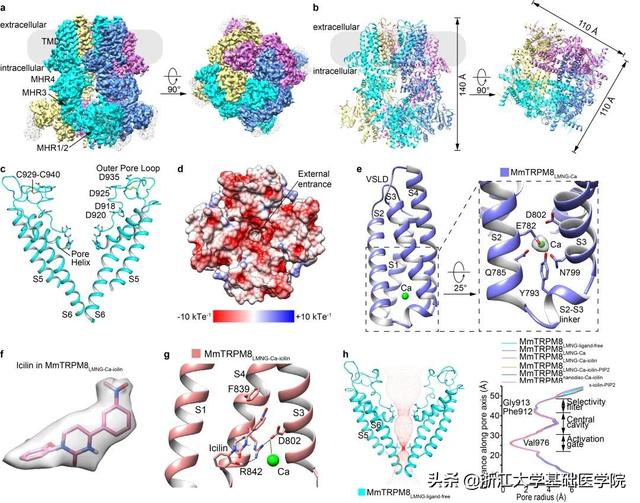
▲图1. 小鼠TRPM8离子通道的结构
a. apo状态下MmTRPM8密度图。
b. apo状态下MmTRPM8卡通模型图。
c. apo状态下MmTRPM8孔道结构域的左右两个亚基。
d. apo状态下MmTRPM8孔区入口外侧表面静电势俯视图。
e. MmTRPM8中钙离子结合位点。
f. MmTRPM8中icilin密度图。
g. MmTRPM8中icilin的结合位点。
h. apo状态下MmTRPM8离子传导路径(左图)和范德华半径(右图)。
本研究系统性地解析了小鼠TRPM8通道在apo以及钙离子和icilin结合状态下的高分辨率结构。揭示了小鼠TRPM8通道的结构和配体识别机制,并为解释TRPM8的不同构象提供了新思路。
浙江大学基础医学院郭江涛课题组博士生赵成、西安第四军医大学西京医院解媛副研究员和浙江大学基础医学院杨帆课题组博士生徐丽臻为论文的共同第一作者。郭江涛、杨帆和解媛为共同通讯作者。本研究受科技部、国家自然科学基金、浙江省自然科学基金等项目的资助。
,