第1节 化学反应的热效应
1.1.1 化学反应的反应热 内能变化


变化观念与平衡思想:
能从质量守恒角度分析化学变化;并能定量分析化学变化及其伴随发生的能量变化。
证据推理与模型认知:
能从宏观和微观结合上收集证据,分析化学变化中的能量吸收或释放的原因。
科学态度与社会责任:
通过对反应热和内能概念的理解,逐步养成严谨求实的科学态度。

反应热概念的含义、内能含义以及与反应热的关系

铝热反应、氢氧化钡和氯化铵反应视频、中和热测定实验试剂和仪器

第一课时 化学反应的反应热 内能变化
【视频引入】多媒体播放铝热反应和氢氧化钡与氯化铵反应的实验视频
【回顾思考】常见的放热反应和吸热反应有哪些?学生思考回答
【投影】1.常见的放热反应
①所有可燃物的燃烧反应,例如H2在Cl2中燃烧;
②酸碱中和反应;
③金属与酸的反应;
④铝热反应;
⑤大部分化合反应,例如CaO H2O==Ca(OH)2。
2.常见的吸热反应
①铵盐与碱的反应;
②C、H2、CO等还原金属氧化物的反应;
③大部分分解反应。
【联想质疑】通常情况下,化学反应中能量的转化主要是化学能与热能之间的转化。化学反应几乎都伴随着热能的释放或吸收,而且在一定条件下,一个反应释放或吸收的热量是一定的。那么,应如何定量地描述一个化学反应释放或吸收的热能呢?用什么方法可以准确地测量一个化学反应释放或吸收的热量?通过理论方法能够计算出化学反应释放或吸收的热量吗?
【问题探究】学生阅读课本相关内容完成学案相关内容
问题一:如何定量地描述一个化学反应释放或吸收的热能呢?
问题二:用什么方法可以获得一个化学反应的反应热呢?
问题三:用什么方法可以准确地测量一个化学反应释放或吸收的热量呢?
【板书】一、化学反应的反应热
【投影总结】一、化学反应的反应热
意义:定量地描述化学反应释放或吸收的热能
定义:当化学反应在一定的温度下进行时,反应所释放或吸收的热量称为该反应在此温
度下的热效应,简称反应热。
符号:Q
规定:Q>0 反应吸热 Q<0 反应放热
【投影总结】1.反应热的数值可以通过实验测得。
2.反应热的数值也可以通过理论计算求得。
热化学:用实验方法和理论方法研究反应热的化学分支。
【阅读思考】阅读课本“资料在线”内容,思考如果知道体系的热容,如何计算体系吸收或放出的热量?
【投影总结】反应热的实验测定仪器和原理

【交流研讨】学生根据反应仪器和原理阅读教材“活动探究”实验操作介绍,思考完成以下问题:
1.根据实验原理分析,对实验结果造成影响的主要因素是什么?在第三步操作中快速将烧杯总的盐酸倒入量热计的目的是什么?
2.在实验室中有玻璃搅拌器和金属搅拌器,在进行测定反应热的实验时应选择哪种搅拌器?
【活动探究】测定中和反应的反应热
学生根据说给仪器和试剂,分组进行实验测定,并根据原理计算反应热的值。完成实验记录表格
实验
溶液温度
反应热/J
T1
T2
NaOH溶液与盐酸反应
KOH溶液与盐酸反应
NaOH溶液与硝酸反应
【交流研讨】为什么三个反应的热效应近似相同?
学生思考交流,发表自己的观点
【投影总结】1.反应的实质相同:H OHˉ== H2O。
2.所用溶液的体积相同,溶液中H+和OH-的浓度相同,即H+和OH-的量相同。
3.反应温度的变化值相同。
【交流研讨】三个反应的热效应不完全相同,造成误差的原因是什么?
学生思考,小组交流,总结造成误差的可能原因
【投影总结】
1.量取溶液的体积有误差
2.温度计的读数有误。
3.实验过程中有液体洒在外面。
4.混合酸、碱溶液时,动作缓慢,导致实验误差。
5.隔热操作不到位,致使实验过程中热量损失而导致误差。
6.测了酸后的温度计未用水清洗而便立即去测碱的温度,致使热量损失而引起误差。
【扩展讲授】在稀溶液中,强酸跟强碱发生中和反应生成1 mol液态水时所释放的热量是相同的,这种反应的反应热叫做中和热。
【迁移应用】有11.2 g KOH的稀溶液与1 L 0.1 mol·L-1的H2SO4溶液反应,放出11.46 kJ的热量,则该反应的中和热为 。
【投影总结】
注意: 1.必须是酸和碱的稀溶液,因为浓酸溶液和浓碱溶液在相互稀释时会放热.
2.强酸和强碱的稀溶液反应才能保证H (aq) OH-(aq)=H2O(l)中和热均为57.3 kJ·mol-1,
而弱酸或弱碱在中和反应中由于电离吸收热量,其中和热小于57.3 kJ·mol-1;
3.以生成1 mol液态水为基准。
4.反应不可以生成沉淀(如Ba(OH)2 H2SO4=BaSO4↓ 2H2O)
【回顾思考】化学反应伴随能量变化的原因是什么? 学生根据高一所学知识思考回答。
【投影总结】化学反应伴随能量变化的原因
1.化学反应的实质:旧化学键断裂吸收能量和新化学键的形成释放能量
旧化学键断裂吸收能量>新化学键的形成释放能量 反应吸收能量
旧化学键断裂吸收能量<新化学键的形成释放能量 反应释放能量
2. 反应物和生成物所具有的能量不同
反应物总能量>生成物总能量 反应释放能量
反应物总能量<生成物总能量 反应吸收能量
【过渡】物质自身所具有的能量,我们通常称为内能,反应体系中内能变化与反应能量变化有什么关系?内能变化与反应热是否相同?
【问题探究】问题四:什么是内能,物质内能与哪些因素有关?内能变化与能量变化什么关系?
学生自主阅读教材相关内容,完成学案问题
【板书】二、化学反应的内能变化与焓变
1.化学反应的内能变化
【投影总结】
内能:体系内所含各种微观粒子的能量总和
影响因素:物质的种类、数量、聚集状态、温度、压强
符号:U
内能变化:△U=U(反应产物)-U(反应物)
内能变化与能量变化的关系:U(反应产物)>U(反应物) 反应吸收能量
U(反应产物)<U(反应物) 反应释放能量
【问题探究】问题五:内能变化与反应热是否相同?有什么关系?
【阅读思考】教材“知识支持”,思考总结化学反应体系与环境间能量交换的形式有哪些,内能变化与反应热的关系。
【投影总结】
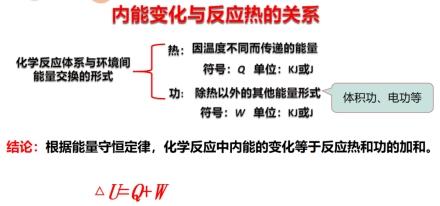
【讲述】若反应过程中体系没有做功,既W=0时,化学反应的反应热(Q)等于化学反应前后体系内能变化(△U),即△U=Q
【投影总结】 U(反应产物)>U(反应物) 反应吸热 Q>0
U(反应产物)<U(反应物) 反应放热 Q<0
【课堂小结】


本节内容为化学反应原理内容,学习起来比较枯燥。为帮学生找到学习的动力,先以常见的两个放热实验视频引入,让学生对高一常见放热反应和吸热反应进行回顾,然后通过“如何定量的描述反应化学反应吸收和释放的能量?”问题入手引入反应热的概念,通过“如何测定化学反应的反应热?”问题入手,使学生加深对化学能与热能相互转化的了解。