前言
QbD是对制药过程中全生命周期的管控。早期设计贯穿全生命周期,避免风险。QbD已逐渐深入药品的开发过程,尤其对于仿制药的开发,QbD是一个很好用工具,它特别专注于从设计到运行,最后终止的整个过程的总成本。分析方法作为药品制造行为的一部分,是用于产生作为GXP决策的基础的数据,其有效性是非常重要的。因此分析方法同样需要采用全生命周期管理,从而以恒定的质量提供这些数据。监管部门对于分析方法的全生命周期管理也越来越重视,因此ICH和USP均提出了关于分析方法的全生命周期管理的相关章程。(比如USP1220、ICHQ8、Q9、Q10)。与QbD相应,一些专家把分析方法的全生命周期管理称为AQbD。采用这种理念设计的分析方法能够增加其耐用性、减少分析方法在验证和批准后变更的工作量,并且能够减少与分析方法相关的OOS数量,这大大有助于降低该方法在其生命周期内的成本。
01分析方法的全生命周期管理概念
分析方法全生命周期管理,也就是AqbD,是一种从预定目标开始的方法,它采用相关知识和风险评估对分析方法进行理解和控制。
ICH和FDA也分别出台了关于分析方法开发、验证、确认和转移的指导原则。虽然这些因素也是分析方法全生命周期管理的一部分,但均被视为独立实体。图1是目前分析方法各因素之间的关系。

图1 传统分析方法各因素之间的关系
而AqbD将分析方法视为一个整体进行考虑,以目标为核心,将ICH相关原则作为辅助,在USP1220中将分析方法的全生命周期管理分为“设计和开发”、“验证和确认”以及“持续确认”三个阶段循环。它特别强调“在正确的时间进行正确的分析”以有质量的方法产生有质量的数据进行保证产品的质量。图2是分析方法全生命周期管理的三个阶段。
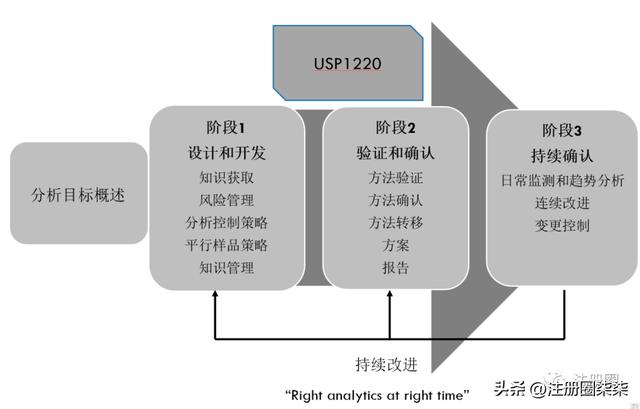
图2 AqbD分析方法的全生命周期
02分析方法全生命周期管理内容
分析方法的全生命周期管理还涉及几个重要的概念:分析目标概要(ATP)是分析方法全生命周期管理的核心,质量风险管理(QRM)是分析方法全生命周期管理的工具,分析控制策略(ACS)是分析方法全生命周期管理实施的保障,知识管理(KM)、设计空间(MODR)、关键质量属性(CQAs)及目标不确定度(TMU)是分析方法全生命周期管理的要素。正是这些概念始终贯穿在分析方法全生命周期管理中,严选了一个高质量的耐用的分析方法。

图3 分析方法全生命周期管理的框架
1)分析目标概要
分析目标概要(ATP)表示预设的目标概述和分析方法所需要满足的质量要求。它是在分析方法设计和开发之间就需要设定的。因此我们可以理解为其不与某个方法和特定技术相联系。
ATP要根据分析方法预期用途设定,不仅仅基于分析方法的性能特性,还要结合外部要求(客户的质量标准、药典和指导原则),内容一般包括:我们需要测什么;在哪里测;测定方法需要达到什么性能和质量;有时可能还会关联分析方法的关键质量属性。
分析方法的目的应在ATP概念中明确定义,通过先验知识选择最合适的分析测量技术。事实上,选择的技术应该与方法的预期目的相匹配,但也应该满足其他要求,例如科学性、实用性和业务相关性

图4 分析方法目标概要
从量化角度考虑,ATP间接定义了分析方法所得数据可接受误差,这种误差就是报告结果中的最大可接受不确定度,我们称之为目标不确定度,它是所有来源不确定度的综合。比如与称量、仪器、积分、平行样品、分析员、样品处理等不确定度。

图5 目标不确定度的来源
由于目标不确定度的存在,分析目标概要还要考虑依据测定结果做出错误决策的可接受风险级别。比如:错误的接受不符合质量标准的批次的风险和错误的拒绝符合质量标准的批次的风险等。一般来说我们会定义一个低于质量标准中限度的数值作为中控限度,这样中控限度和质量标准的限度就组成了一个过渡区,进而形成保护带,从而降低做出错误决策的可接受风险级别。图6是决策保护带的示意图。

图6 决策保护带
根据方法的预期用途,方法的要求包括性能标准精度、选择性、灵敏度、线性和耐用性,但也包括样品周转时间、通过能力、分析总成本和易操作性。一旦定义了ATP,就需要根据分析人员的知识选择最有可能提供符合ATP的分析数据的分析技术。随后,可通过方法设计和风险评估继续分析方法的生命周期。
由于ATP描述了可报告值的质量属性,因此它在分析方法的全生命周期中应用,并连接其所有阶段。
2)质量风险管理
风险管理是一个在任何领域都会用到用于降低风险的工具。在分析方法全生命周期管理中是一个用于评估、控制、沟通和审查数据质量风险的系统过程。它和ATP一样也是贯穿于分析方法的全生命周期中。在分析方法的设计和开发阶段,经常通过“鱼骨法”了解对分析方法有影响的变量,和其对分析方法影响程度的分析。图7是一个HPLC分析方法的评估模式,其对HPLC分析方法有潜在影响的变量,比如:固定类型、样品制备、流动相选择、仪器选择等,进行了统一分析。图8是风险管理的流程图,其在各个领域均适用。

图7 HPLC分析方法风险评估模型

图8 风险管理流程图
3)设计空间
“设计空间”是分析方法全生命周期管理中一大亮点,它是变量对分析方法的耐用性和质量没有显著影响的试验安全区,是基于风险评估后而形成的一个多变量区间。设计试验法(DoE)是制造设计空间的工具,它将所有变量和测量结果联系起来。
在分析方法设计和开发中,常规做法是采用“单变量”模式进行,这也是目前90%的药物分析人采用的开发策略。不过,这种模式产生的分析方法具有非常窄的耐用性,更不能直接识别分析方法的关键质量属性。分析方法在转移过程中经常出现问题,“生命”很短暂。而采用“DoE”的多变量开发模式则恰恰相反,其将多种变量同时考虑,产生高耐用性的分析方法,能够识别分析方法的所有关键质量属性。最终重要的是当分析方法的参数在设计空间内变动时,该方法的使用是不需要经过批准的。
4)分析控制策略
“DoE”识别出来的关键变量需要采用适当的策略进行控制。从而引入了“分析控制策略”概念,其是为了检验分析方法在整个生命周期内满足ATP所采用的控制方法。常用的方法主要有:建立关键变量的限度区间;系统适用性;平行样品;环境控制;样品制备;监测和控制频率及测量结果的报告格式等。分析控制策略是一组计划的控制,是风险管理后的输出。图9是分析控制策略、知识管理和质量风险管理的相互关系图:

图9 分析控制策略、知识管理和质量风险管理迭代图
可以看出其也是一个小的生命迭代过程。分析控制策略在确保ATP在整个生命周期中实现方面发挥着关键作用。在不同的实验室或使用不同的设备时,可能需要Case by Case的控制策略。
5)阶段1分析方法的设计和开发
AQbD的目标是设计一种始终满足ATP的方法,以有效控制原料药和制剂的CQAs。这种新方法从方法目标和质量要求的预定义开始。该阶段主要有方法设计、方法理解和风险降低三个行动,以知识管理、质量风险管理和分析控制策略贯穿其中。

图10 方法的设计和开发流程图
当ATP确定之后作为分析方法的关键性能参数,分析者需要选择合适的技术和分析方法来满足ATP的要求,采用先验知识(比如HPLC)确定变量的潜在来源。这些知识包括但不限于:分子中存在的所有分析物的pKa值、微生物分布与pH值的关系、logP(分配系数)、logD vs pH和极性范围信息。然后采用风险管理来帮助开发耐用性的分析方法,主要有确定对分析方法由潜在影响的变量(C.N.X)、评估变量对分析方法的潜在影响和采用DoE产生变量的设计空间等几种方式。通过有效的分析控制策略(ACS)控制变量的来源。ACS是在整个分析方法生命周期中为消除风险或将风险控制在可接受水平而采取的全部步骤。它依赖于对方法的理解,将大型复杂过程分解为可管理的步骤,并评估潜在的方法失败及其对可报告结果的影响。在方法设计阶段开发了初步的ACS;但是,它是在阶段2验证和确认完成的。在阶段2对其进行监控,以确认它仍然有效,并且可以相应地更新。
AQbD方法的成功将取决于从一开始就实施的情况,从而以积极主动的方式解决可能在整个分析方法生命周期中发现的方法的弱点。应在任何DoE活动之前使用正式的风险管理方法,然后生成逻辑方法开发时间表和方法控制策略。
6)阶段2分析方法验证和确认
在阶段1中分析方法和初步ACS确定、减少或消除潜在偏差之后,分析方法的生命周期的下一阶段涉及确认该方法满足ATP的要求。该阶段称为分析方法验证和确认,旨在识别在不同实验室使用该方法时可能引入的其他可变性来源,并提高对整体方法精度的理解,以确保符合ATP。
如果阶段2失败,则重新访问阶段1,并应执行额外的开发活动。反之,应进行评估以确定是否满足ACS中概要的标准,然后再常规使用。实际上,可以通过添加其他控制来重新定义或更新该策略,例如,添加到系统适用性标准中,以减少在最终用户实验室使用该方法期间确定的可变性来源。通过增加重复次数或结果格式是减少分析方法产生的可报告值的可变性的一种可能策略。
7)阶段3分析方法持续确认
一旦建立了ACS并作为分析方法生命周期的一部分进行了验证或确认,下一步就是方法的持续确认,以提供持续的保证,确保它仍然适用。比如:日常监测分析方法性能(系统适用性、信噪比和峰形)、如发生变更,分析方法是否还能满足ATP。
日常监测一般采用趋势分析控制图,图11用于监测容量法的系统精度,用于测定原料药中水分含量,前10针结果显示系统精度的高度可变性,深入调查,所有结果均为同一分析人员使用同一台仪器。因此确定一个特殊原因—滴定液—得出结论是可变性与方法无关。而后8针均符合可接受标准(2.0%)。

图11 容量法水分测定趋势分析控制图
而测量结果出现超标(OOS)或超限(OOT)情况时可能发生:a特殊原因变化(不期望现象,漂移、偏差和偏移等)、b不可接受的同工原因(固有的预期可变的,噪音等)、c持续改进。
上述a、b原因主要是因为:

对性能不足的调查应彻底且有充分的文件记录,并应旨在就真正的根本原因变量得出结论。应采取纠正和预防措施,以确保分析方法的分析控制策略得到更新。
在分析方法的整个过程的生命周期中,可能需要进行更改以改进操作性能或控制策略(持续改进)。经过风险评估后变更方式包括但不限于:引入附加控制、引入新的方法和技术、改变ATP,引入新杂质和收紧限度、于更新后的药典保持一致。
变更的类型主要有以下5种。当不同类型的变更发生时具有不同的处理方式。可按照图12所示进行处理。
- 变更1:在已验证范围内(设计空间内)的变更被视为调整,不需要在恢复常规监测之前进行分析方法开发和验证;
- 变更2:超出了已验证范围,但只需要确认分析方法继续符合ATP要求。不需要完整的分析方法重新开发,进入阶段2;
- 变更3:设计在不同环境操作分析方法,被看成分析方法转移或方法验证,进入阶段2;
- 变更4:保持ATP不变,要求一个新的分析方法,进入阶段1和阶段2;
- 变更5:收紧质量标准限度或改变分析目的,进入阶段1和阶段2,重新制定新的ATP。

图12 不同类型的变更发生时处理流程图
8)分析方法失效
从本质上来说,分析方法的全生命周期的最后一个阶段是分析方法的失效,其退休也应遵循质量管理原则。需要考虑数据存储,特别是如果该方法用于监管环境中。为了能够在原始分析方法终止后的几年内重新评估数据,还需要考虑相关软件的存储。一种方法可能因实验室范围的变化而完全终止,或者一种新方法可能基于已得出的结论,以满足新定义的ATP要求。如果新方法基于失效方法,则可以使用早期生命周期的某些部分来启动新方法。
03全生命周期管理的分析方法的优势
全生命周期管理的分析方法与传统分析方法相比,主要优势在于:a将分析方法的各个阶段捏合成一个整体进行管理、b理解、减少和控制对分析方法有潜在影响的变量、c减少了超限(OOS)和调查的发生、减低了分析方法转移失败的概率、d分析方法可以在设计空间内应用、e设计空间概念使分析方法更加灵活的应对变更的发生、f提高透明度。
04分析方法全生命周期管理的展望
使用全生命周期管理原则进行分析方法开发需要从整体角度考虑方法稳健性以及过程和产品可变性。只有这样,才能确保在其整个生命周期中获得可靠、准确和一致的性能方法,并确保所释放的药物原料和制剂的安全性和质量。
此外,在开发过程中应用一种有效的、系统的和基于科学的方法,被认为是AQbD,更有可能增加对方法的理解并控制可变性的来源。提高方法稳健性、降低成本和降低故障风险是这种生命周期管理的一些内在优势,监管机构和行业都明确承认。
各种指导原则的相继推出,使得使用和掌握这些概念和方法的行业成熟度正在提高,但“商业案例”需要不断加强。新方法为该行业提供了敏捷性,为患者提供了更高的安全性和质量保证,并为监管机构提供了更高的监管期望,从而在没有广泛监管监督的情况下更加确定了合规性。
最后,笔者认为,其实分析方法都是错误的,关键在于这个分析方法的错误有多大,这个错误是否能够被接受。所以,请不要再责备你的分析员了。
参考文献
[1] Koteska L , Tonic-Ribarska J , Trajkovic-Jolevska S . Analytical procedures lifecycle management: An overview.
[2] Parr M K , Schmidt A H . Life Cycle Management of Analytical Methods[J]. Journal of pharmaceutical and biomedical analysis, 2017, 147:506-517.
[3] Jmr A , Vb B , Lb B , et al. Application of the Life Cycle Management of Analytical Methods concept to a HPTLC-DPPH assay method for acteoside content in industrial extracts of Plantago lanceolata L[J]. Journal of Chromatography B, 2021.
[4] Barnett K L , Mcgregor P L , Martin G P , et al. Analytical target profile: Structure and application throughout the analytical lifecycle[J]. Pharmacopeial Forum, 2016, 42(5).
[5] Kovacs E , Ermer J , Mcgregor P L , et al. Analytical control strategy[J]. Pharmacopeial Forum, 2016, 42(5).
[6] Burgess C , Curry P , Leblond D J , et al. Fitness for use: Decision rules and target measurement uncertainty[J]. Pharmacopeial Forum, 2016, 42(2).
[7] Ljupka Koteska , Jasmina Tonic-Ribarska , et al. Analytical procedure lifecycle management: An overview, 2018, 8(10)
[8] 网络资源(如有原创观点引用,请联系备注出处)
声明“:本文转载来源于公众号【注册圈】,文章版权归原作者所有,如若了解更多信息可自行前往查看。
原文链接:https://mp.weixin.qq.com/s/gmyXScLYPqKAb_6X3OKtMQ
,




