本节课对应人教版教材化学必修一,第一章从实验到化学的内容。 主要内容包含:知识体系架构和四个重要的微专题。 同名公众号(FIve课堂)还为大家提供了详细的思维导图、清晰的课程目录,方便各位同学复习记忆,以及本节课程的视频原文件供大家免费下载,方便大家反复观看复习。 谢谢您的支持。
以下为文字版:

同学们好,欢迎您来到Five课堂,今天我们对必修一的第一章进行一个单元复习。

本节课主要分为以下两大方面,分别是知识体系架构和微专题,我们首先进入第一部分,知识体系架构。

1、化学实验基本方法。
主要包括三大块内容,分别是化学实验安全、混合物的分离和提纯和常见离子的检验。
我们先来看实验安全部分,需要大家了解以下四方面内容:遵守实验室规则、了解有关安全措施、掌握正确的操作方法以及了解意外事故的处理方法。
接下来我们来看混合物的分离和提纯,又可分为物理方法和化学方法,常用的物理方法有:过滤,依据混合物的状态不同进行分离,常用于固液分离;蒸馏,依据混合物的沸点不同进行分离,常用于液液分离;萃取,则是根据溶质在不同溶液中的溶解度不同进行的分离。
在使用化学方法进行分离提纯的时候,一般遵循“不增、不减、易分离、易复原”,的原则。
不增,是指不能引入新的杂质;
不减,是指被提纯的物质不能被损耗;
易分离,是指用加入相应的试剂后杂质与待提纯物容易分离;
易复原,是指被提纯物易复原为初始状态。
常用的方法可分为加热法和加试剂法,沉淀法、气化法等都属于加试剂法。
常见离子的检验:例如碳酸根、硫酸根、氯离子的检测等。
这就是化学实验基本方法的知识架构。

接下来,我们进入2、化学计量在实验中的应用
主要分为有关物质的量的重要概念、万能恒等式、阿伏伽德罗定律及其推论和一定物质的量浓度溶液的配置四个部分。

我们需要掌握的基本概念有:物质的量、摩尔、阿伏伽德罗常数、摩尔质量、气体摩尔体积、物质的量浓度等。

万能恒等式:物质的量=质量/摩尔质量=粒子数/阿伏伽德罗常数=气体体积/气体摩尔体积=溶液浓度×溶液体积。

阿伏加德罗定律及其推论,由于时间原因我们不再展开讲,各位同学可以通过文后链接快速跳转至第二节第二部分进行学习。

一定物质的量浓度溶液的配置
原理:B的物质的量浓度=B的物质的量/溶液体积。
主要仪器,容量瓶等。
基本步骤可分为:计算称量、溶解、转移、洗涤、定容和摇匀。
误差分析,根据公式变形得c=m/MV,根据m和V的变化判断浓度变化。

接下来我们进入第二部分,微专题。

1、混合物的分离和提纯。
(1)常用方法有:过滤、蒸发、蒸馏、萃取和分液。我们分别来看。
首先我们来看过滤,用于从液体里分离不溶的固体物质,例如除去粗盐中的泥沙,需要注意的有“一贴、二低、三靠”,例外如果产品为沉淀时需要洗涤沉淀。

蒸发,用于分离溶于溶剂中的溶质,例如蒸发NaCl溶液获得NaCl晶体,需要注意是蒸发时要不断搅拌防止液体飞溅。

蒸馏,用于分离沸点不同而又相溶的液态混合物,也可分离固液混合物。例如分离乙醇和水,利用蒸馏水制备纯净水。蒸馏时需要注意1、温度计水银球上沿与支管口下沿平齐;2、加沸石;3、冷凝水“下进上出”。
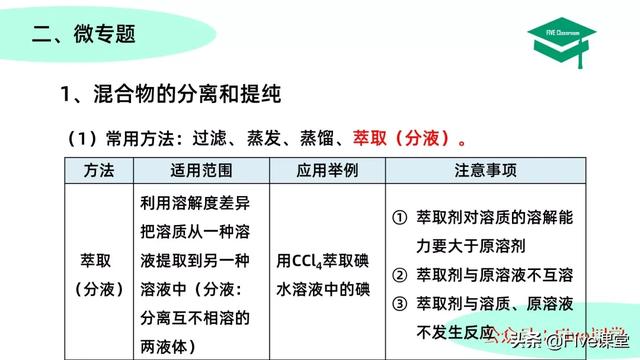
萃取、分液,萃取是利用溶解度差异把溶质从一种溶液提取到另一种溶液中,分液用于分离互不相溶的两液体。例如用CCl4萃取碘水溶液中的碘,需要注意1、萃取剂对溶质的溶解能力要大于原溶剂;2、萃取剂与原溶液不互溶;3、萃取剂与溶质、原溶液不发生反应。

(2)提纯化合物的基本要求
“过量”,为了除尽杂质,除杂试剂要添加过量。
“后除前”,后面加入的试剂能够把前面加入的试剂一并除去。
沉淀完全的判断方法,在上清液中滴加沉淀剂不再有沉淀生成时为沉淀完全。
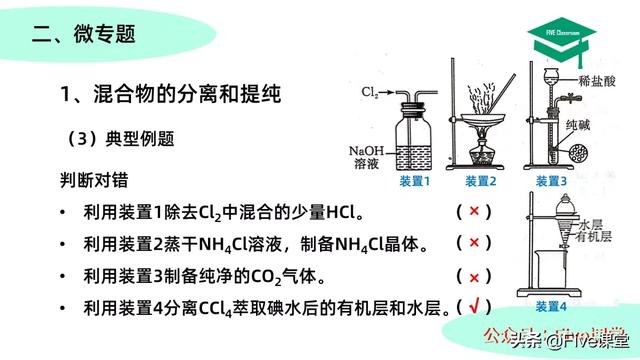
典型例题,判断对错,请各位同学先暂停视频,自己先尝试判断。
好了,我们一起来看,第一题,利用装置1除去Cl2中混合的少量HCl。很明显,NaOH不仅会与混合的HCl发成反应,还会与氯气发生反应。因此,第一题错误。
第二题,利用装置2蒸干氯化铵溶液来制备氯化铵晶体,我们知道氯化铵受热易分解为氨气和氯化氢,因此用装置2不能得到氯化铵晶体。所以第二题也是错误的。
再来看第三题,利用装置3制备纯净的CO2气体。乍一看之下似乎没有问题,但是通过仔细读题我们会发现题中要求的是制备纯净的二氧化碳气体,而装置3中制备的二氧化碳气体中会不可避免的混有少量的氯化氢气体和水蒸气,并不符合题目要求。而若制备纯净的CO2则还需要将制备出的气体通过纯化装置才能达到要求。因此这道题也是错误的。
我们来看最后一题,利用装置4分离CCl4萃取碘水后的有机层和水层。装置4是一套完整的分液装置。因此这道题是正确的。

我们来进入第二个微专题,实验室中的安全问题。
(1)基本要求。
在实验室中要做到“三不”,即不尝、不手拿、不直接闻。
放爆裂,玻璃容量瓶加热前外壁擦干,烧瓶、锥形瓶、烧杯隔石棉网加热,加热固体试管口略低于试管底。
防爆炸,点燃气体前要验纯。
防暴沸,加热液体前要加沸石。

防失火,加热或点燃时远离不相关可燃物,同时我们还要掌握实验室失火的处理措施。
实验中要防止倒吸。
防污染,常用尾气处理有燃烧式、吸收式和收集式。
防堵塞,防止导管堵塞。

(2)典型例题,不纯的H2点燃时可能会发生爆炸,为防止意外,可连接一个安全装置,下列能起到此作用的装置是?同样,请各位同学先暂停视频,自己先尝试判断。(稍事停顿)相信同学们已经有了自己的答案,我们一起来看,首先观察选项,先理解题目中的安全装置是如何防止爆炸的。假设我们点燃了不纯的氢气,火焰会顺着导管燃烧首先到达试管中,并会在试管中发生爆炸,由于试管有一个用乳胶头堵住的侧管,爆炸引起的压力会冲开乳胶头泄压,并不会造成伤害。此时试管还需要起到隔绝火焰的作用,避免火焰继续顺着导管燃烧至气体发生装置而引起更大的爆炸,从而起到防止爆炸的作用。通过观察选项,A中从气体发生装置出来的导管没有浸入到液体中,不能起到阻隔火焰的作用,C和D中气体发生装置中产生的氢气也不能顺利导出,同样不正确。只有B装置能够起到防止爆炸的作用。
因此这道题选择B。

我们进入专题3、以物质的量为核心的计算。
首先我们来看(1)核心公式。
溶液体积×物质的量浓度=溶质物质的量;
溶质物质的量÷物质的量浓度=溶液体积;
标况下气体物质的量×22.4 L/mol =气体体积;
标况下气体体积÷22.4 L/mol =气体物质的量;
物质的量×阿伏伽德罗常数=微粒数;
微粒数÷阿伏伽德罗常数=物质的量;
物质的量×摩尔质量=质量;
质量÷摩尔质量=物质的量。

同样重要的几个公式还有,物质的量=质量/摩尔质量=粒子数/阿伏伽德罗常数=气体体积/气体摩尔体积=溶液物质的量浓度×溶液体积。
稀释定律:=, =
另外我们还需要掌握常用公式的变形,=/ =/(( ))
=/( )×%相关推导过程在前面的课程中已经讲过,记不清楚的话可以回过头去再复习一下。

(2)注意
相关物理量在进行相互换算时,都要经过“立交桥”的中枢,即物质的量。
应用气体摩尔体积等于22.4 L/mol时,必须是标准状况下。
另外还要注意一些特殊情况:
比如特殊物质存在状态,例如SO3标况下为固体,CCl4、C2H5OH、H2O等在标况下为液体。

又比如特殊的物质组成,例如盐酸是HCl的水溶液,等物质的量的CO与NO含有相同的原子数,等质量的NO2和N2O4含有相同的原子数等。
我们在做题时要特别注意这些容易被忽略的陷阱。

(3)典型例题,判断对错,请各位同学先暂停视频,自己先尝试判断。
我们一起来看,第一题,常温常压下,14 g N2和CO组成的混合气体含有原子数为NA。氮气和一氧化碳的摩尔质量都是28 g/mol,所以14 g N2和CO组成的混合气体是0.5 mol,并且和温度压强无关,更巧的是氮气和一氧化碳都是双原子分子,所以混合气体中不论N2和CO以什么比例混合,其中的原子数都是NA个。所以这道题是正确的。
第二题,常温常压下,8 g O2含有2NA个电子 。在做这道题的时候要注意审题,题目中问的是O2中有几个电子,不能惯性思维的当成问几个原子,更不能想当然的认为是成键电子或者是电子对。8 g氧气是0.25 mol,而O2共有16个电子,因此共有电子0.25×16=4 mol。也就是4NA个电子。因此这道题错误。
第三题,标准状况下,22.4 L盐酸含有NA个HCl分子。这道题考查的就是我们刚刚提到的要注意特殊的物质组成,盐酸是HCl的水溶液,因此题目中的说法肯定是错误的。
来看最后一题,已知C2H4和C3H6的混合物质量为a g,则该混合物所含原子总数为/。我们来分析题目,C2H4和C3H6的相对分子质量并不相同,但是都有由(CH2)这个基本单元组成,那么我们可以将(CH2)看作一个整体来进行分析。a g混合物中有(CH2)a/14 mol,而每个(CH2)单元有3个原子,因此a g混合物中应该有3a/14 mol 原子,即3aNA/14个原子。所以题目中的说法不正确。

我们进入最后一个专题,4、一定物质的量浓度的溶液的配置及误差分析。
我们直接来看例题,同样,请各位同学先暂停视频,自己先尝试判断。
我们一起来看。第一题,用如右图装置配置0.1 mol/L的NaOH溶液。我们在前面的课中多次强调不能用容量瓶来进行溶解或者稀释,而图中直接在容量瓶中溶解氢氧化钠是不可以的。这道题错误。
第二题,洗干净的容量瓶放进烘箱烘干。这道题也是不对的,容量瓶不能烘干而要自然晾干。
第三题,配置溶液定容时,仰视容量瓶刻度会使溶液浓度偏高。这道题也是错误的,,仰视会使溶液体积增多,这样会导致溶液浓度降低。
第四题,Ca(OH)2能制备澄清石灰水,所以可以配置2 mol/L的Ca(OH)2溶液。这道题也是不对的,由于Ca(OH)2微溶于水,且溶解度随着温度升高而降低,0 ℃其溶液度约为0.185 g,室温下的溶解度约为0.165 g,而若要配置2 mol/L的Ca(OH)2溶液,根据= /(( )),我们把ρ近似当作1 g/mL,可得到其溶解度至少要为约17.4 g,所以氢氧化钙是不能够配置成2 mol/L的溶液的。

我们再来看另外两道题,请大家先自行思考。
我们一起来看,配置0.1000 mol/L氯化钠溶液时,将液体转移到容量瓶时用玻璃杯引流。这道题的说法是没有问题的。这道题还给我们另外一个信息点,用容量瓶配置溶液时,一般可以保留四位有效数字,正如题中的那样。
欲配置1.00 L 1.00 mol/L的NaCl溶液,可将58.5 g NaCl溶于1 L水中。很明显这道题是错误的,溶液物质的量浓度中的体积一定是溶液的体积而不是溶剂的体积,所以题中的说法是错误的。并且配置一定物质的量浓度的溶液要使用容量瓶。

最后给大家留下一道思考题,请大家截屏保存,并自己尝试解答,下期视频中我将为大家带来对这道题的详细解析。

以上就是本节课的全部内容,感谢您的观看。关注Five课堂 可以免费下载本视频以及课程配套思维导图,祝您学习、生活愉快,我们下期再见。
,




