血色病,又叫含铁血黄素沉着症或血色素沉着症,分为原发性血色病及继发性血色病,如何对其进行鉴别诊断,是临床医生面临的重要问题及挑战。
近日,在第二届“金城肝病论坛”学术会议暨第八届甘肃省中西医结合肝病中心年会上,首都医科大学附属北京佑安医院郑素军教授从临床病例出发,深入浅出地介绍了血色病的诊断思路,《国际肝病》特将报告内容整理如下,以供临床医师参考。
从两例肝脏铁超载患者说起【病例1】
患者男性,48岁,发现脾大、糖尿病2年余。常见病因学阴性。血清学指标显示:谷丙转氨酶(ALT)113 U/L,谷草转氨酶(AST)84 U/L,血清总胆汁酸(TBA)52.2 μmol/L,血清总胆固醇(CHOL)5.76 mmol/L,铁蛋白>2000 ng/ml,Fe 47 μmol/L,总铁结合力(血清中的转铁蛋白所能结合铁的最大能力)48 μmol/L,转铁蛋白饱和度97.9%,未饱和铁结合力1 μmol/L。
全外显子测序(WES)结果显示:TFR2: c.G1288A,p.G430R杂合突变[1],TFR2: c.T960A,p.Y320X杂合突变(图1)(综合其兄弟、姐妹测序结果,判断为复合杂合突变)。最终诊断原发性血色病(3型)。

图1.病例1患者的基因测序结果[2] (引自讲者幻灯)
【病例2】
患者男性,42岁,既往有银屑病史,曾间断服用中药,以下肢浮肿2周、肝硬化原因待查收入院。常见病因学阴性。血清学指标显示:总胆红素(TBIL)36.6 μmol/L,白蛋白(ALB)26.2 g/L,Fe 18 μmol/L,铁蛋白598 ng/ml,总铁结合力32 μmol/L,转铁蛋白饱和度56.25%,未饱和铁结合力14 μmol/L。
WES未检出血色病相关基因致病突变。最终诊断继发性血色病,肝脏铁超载考虑继发于肝硬化(药物性可能性大)。
铁超载如何鉴别?铁过载是由于铁供给和吸收超过了机体的需要,引起体内总铁量过多,铁沉积于重要组织和器官,可导致脏器损伤及功能障碍。血色病是一组铁代谢异常性疾病,是由于体内铁过量沉积于肝脏、胰腺、心脏等器官,并对这些器官的结构和功能造成损害的疾病状态。按其病因不同,分原发性(遗传性)和继发性两类,后者多在血液(贫血)、肝脏等疾病基础上发生。
遗传性血色病根据致病基因的不同,可分为4个类型:1型也称HFE相关遗传性血色病,为染色体6p21.3上的HFE基因突变;2型分为2A及2B型,其中2A型致病基因为铁调素调节蛋白(HJV)基因,2B型为编码铁调素的HAMP基因;3型致病基因为转铁蛋白受体2(TFR2);4型为编码膜铁转运蛋白(又称运铁素,Ferroportin)的SLC40A1基因。其中1~3型又称为非HFE相关血色病。1型血色病在有欧洲血统的白种人高发,患病率高达1/250-1/220。我国原发性血色病总体少见,1型更为罕见,诊断的血色病多为非HFE相关血色病。
继发性铁过载临床常见,主要见于铁过载贫血(如重型地中海贫血、铁粒幼细胞贫血、再生障碍性贫血等)、胃肠外铁过载(如右旋糖酐铁注射、长期血液透析等)、慢性肝病(如病毒性肝炎、酒精性肝病等)以及代谢障碍性铁过载综合征。此外,尚需注意其他罕见的铁超载疾病,包括先天性转铁蛋白血症和先天性低转铁蛋白血症。

图2.血色病的鉴别诊断 (引自讲者幻灯)
血色病的鉴别诊断:综合判断原发性血色病及继发性血色病,临床治疗可能大相径庭。如何对其进行鉴别诊断,是临床医生面临的重要考验。郑素军教授在报告中分别从发病机制、临床表现、铁生化检查、影像学以及病理学检查等方面,概述了血色病的鉴别诊断。
发病机制
铁主要来自外源性小肠吸收,以及内源性巨噬细胞对衰老红细胞的吞噬后再利用。铁水平受铁调素-运铁素轴严苛监控。正常生理条件下,转铁蛋白转运三价铁至肝细胞,通过与肝细胞膜上HFE、TFR2和HJV等组成的受体复合物结合、调节铁调素表达;而铁调素与小肠黏膜细胞或巨噬细胞上运铁素(FPN)结合,引起后者内吞而降解,限制肠铁吸收或巨噬细胞释放铁。铁调素是分泌性蛋白,直接抑制运铁素,其水平受多种因素影响。当循环中血清铁水平升高时,铁调素分泌相应增多,作用于细胞膜上的运铁素,阻碍内源、外源铁向循环铁池中流动。该系统中任何分子的异常都会引发铁代谢异常。
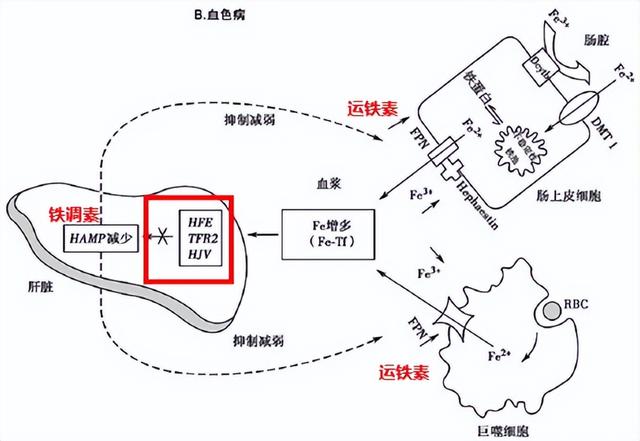
图3.铁的正常代谢[3] (引自讲者幻灯)
比如原发性血色病1~3型,HFE、TFR2和HJV突变抑制铁调素合成,小肠细胞和巨噬细胞经运铁素(FPN)释出铁增加;血浆转铁蛋白饱和度增加(正常<30%)、非转铁蛋白结合铁(NTBI)升高(当转铁蛋白饱和度>45%时),NTBI易在肝、胰、心脏等实质细胞沉积,产生氧化应激、线粒体损伤,组织损害和功能障碍[4-5]。原发性血色病4型又分为4A型及4B型,其中4A型又称Ferroportin病,是SLC40A1基因突变导致运铁素的功能丧失,导致铁不能从巨噬细胞释放而在肝脾沉积;4B型是运铁素功能获得,使其对铁调素的负调节作用不再敏感,小肠细胞和巨噬细胞释出铁增加,产生铁超载。
因无效造血导致的贫血,贫血本身可诱发HAMP合成减少,导致肠铁吸收增加、巨噬细胞释出铁增多,铁在实质细胞沉积为主;当红细胞无效造血严重,或继发输血时,巨噬细胞吞噬铁增多,铁可在间质细胞沉积。酒精性肝病、病毒性肝炎、肝硬化多为铁调素下调导致的铁超载发生[6]。铁调素主要在肝脏合成,肝硬化时可引起铁调素表达减少。
临床表现
原发性血色病可表现为肝硬化、糖尿病、皮肤色素沉着“经典三联征”。患者临床表现与突变基因、铁超载速度和强度相关。2型青少年血色病容易波及青少年,因血中铁调素水平更低,血清铁浓度更高,铁易在胰腺、心脏等富含线粒体的脏器沉积而出现相应脏器功能障碍。而3型、4型、1型血色病患者发病年龄较大、起病慢。
对于地中海贫血、尤其重型地中海贫血患者,反复输血可引起较为明显的铁超载症状。与原发性血色病鉴别点为,除铁超载症状外,患者往往存在贫血的相关症状、体征及实验室检查,可出现黄疸(间接胆红素为主),网织红细胞计数增多。
而对于继发于慢性肝病患者的铁超载症状多较轻,主要为肝病表现。但铁超载是肝病进展的风险因素,例如过量肝铁可能在NASH纤维化向肝细胞癌的发展中发挥作用。病毒性肝炎患者的肝铁沉积可能会导致肝纤维化、肝硬化、胰岛素抵抗、血清低密度脂蛋白(LDL)和胆固醇水平上升,以及肝脏脂肪变性。

图4.原发性血色病[7] (引自讲者幻灯)
铁生化检查
对于1、2、3和4B型血色病,血清铁、铁蛋白、转铁蛋白饱和度升高;而4A型虽然体内储存铁增多(表现为铁蛋白增高),但其致病机制为运铁素功能丧失而导致巨噬细胞外排铁障碍,故血清铁可降低或正常,转铁蛋白饱和度可正常或降低;继发于肝病的铁超载,血清铁、铁蛋白常升高;转铁蛋白饱和度虽然在少数患者也可升高,但多数在正常范围或<45%,这是与原发性血色病的一个重要的鉴别点。

图5.铁相关检查结果对比[8-10] (引自讲者幻灯)
此外,还应注意与其他遗传性疾病所继发的铁超载鉴别,如遗传性无铜蓝蛋白血症、遗传性低转铁蛋白血症。低铜蓝蛋白时,由于不能将二价铁氧化为三价铁运输,故转铁蛋白饱和度正常或下降,患者可出现小细胞低色素样贫血;后期可出现糖尿病、视网膜变性、共济失调和痴呆。其肝病变常轻,与肝豆状核变性不同,该病肝内无铜沉积,很少发展为肝硬化。
而遗传性低转铁蛋白血症的特点是转铁蛋白缺乏或低,血清铁蛋白高,血清总铁结和合力(TIBC)下降,转铁蛋白饱和度升高等。
影像学检查
MRI可用于诊断是否存在铁过载,评估铁沉积严重程度和分布模式。正常个体肝铁浓度(HIC)范围:10~35 μmol/g干重。≥1.5特斯拉核磁可准确检测50~350 μmol/g干重肝铁含量。正常情况下,肝脏的信号高于竖脊肌及脾脏信号。当肝实质铁超载时,肝脏信号下降(尤其T2加权像),表现为“黑肝”。
MRI可识别肝脏内铁的不均一分布,区分实质(脾信号正常,肝脏、胰腺和心脏信号低)和间质(脾信号下降,“黑脾”)铁过载。
原发性血色病1、2、3和4B型,铁常在肝细胞等实质细胞沉积,MRI表现为“黑肝”;4A因铁在巨噬细胞沉积而表现为“黑脾”。
贫血、输血铁超载时,铁在单核细胞沉积(脾脏、肝脏、骨髓等信号降低),后期铁可从巨噬细胞溢出而被肝脏、胰腺等实质细胞摄取,脾脏、肝脏、骨髓、胰腺MRI信号均降低。
肝硬化合并铁超载时,铁调素合成下降,铁主要在实质细胞沉积,MRI表现为肝脏、胰腺信号降低;酒精性肝病因铁调素下降及巨噬细胞吞噬铁增多,肝脏、脾脏信号均可降低。
但需注意的是,无论原发性血色病还是继发性铁超载,疾病后期当铁沉积严重时,铁在实质细胞和间质细胞均可沉积,MRI则难以区别原发性血色病及继发性血色病。

图6.原发性血色病MRI (引自讲者幻灯)

图7.贫血、溶血、输血铁超载MRI (引自讲者幻灯)

图8.慢性肝病MRI (引自讲者幻灯)

图9.各类血色病MRI结果对比 (引自讲者幻灯)
病理诊断
随着非侵入性铁超载量化方法的发展,肝活检已不推荐用于肝脏铁超载的诊断。但肝穿刺仍可用以下情况:纤维化分期的评估(铁蛋白>1000 ng/ml,或肝酶升高时)、排除其他同时存在的肝病、对不能分类的遗传或获得性铁过载进行病因诊断及预测预后。
不同类型血色病的病理结果如下:原发性血色病(1、2、3和4B型),早期肝实质内铁沉积,后期巨噬细胞也可分布;其中铁在胆管上皮沉积是原发性血色病的特点。
输血或溶血时,铁沉积早期以间质细胞(枯否细胞为主)为主;其他肝病,铁沉积的程度多较轻,并伴随相应肝病病理改变。

图10.原发性血色病病理改变 (引自讲者幻灯)

图11.输血或溶血病理改变 (引自讲者幻灯)

图12.其他肝病病理改变 (引自讲者幻灯)
血色病诊断思路:熟知临床特征,及时二代测序郑素军教授指出,临床怀疑血色病、转铁蛋白饱和度和铁蛋白升高的非欧洲血统患者,检测到HFEp.Cys282Tyr变异的可能性非常低,可直接对HFE和非HFE基因进行测序。

图13.血色病诊断思路示意图 (引自讲者幻灯)
小 结原发性血色病在我国少见,大多为继发性。仔细辨别患者症状、体征及病史有助于区别原发性或继发性血色病。血清铁蛋白、转铁蛋白饱和度升高模式,有助于缩小诊断范围;MRI有助于判断有无铁沉积、铁沉积程度及沉积模式;二代测序有助于确诊,鉴别原发或继发;肝穿病理则有助于判断铁沉积程度、模式,以及是否并存其他病因。
参考文献:
1. Silvia Majore, et al. Blood Cells Mol Dis. 2013 Jan;50(1):31-2.
2. Tang S, et al. Front Genet. 2022 Apr 8;13:836431.
3. Kowdley KV, et al. Am J Gastroenterol. 2019, 114(8): 1202-1218.
4. Pietrangelo A. Gastroenterology. 2010, 139(2): 393-408.
5. Charles T Quinn, et al. Pediatric blood & cancer. 2016 May;63(5):773-80.
6. CZAJA AJ. Aliment Pharmacol Ther. 2019;49:681-701.
7. Pietrangelo A. Gastroenterology. 2010, 139(2): 393-408
8. Aliment Pharmacol Ther. 2019;1–21
9. Taher AT, et al. Hematology Am Soc Hematol Educ Program. 2017
10. datz c, et al. Minerva endocrinol 2017;42:173-83.
,




