1.首先要固定小鼠,把小鼠放在盒子里面,让它的尾巴伸在盒盖的外面,用手抓住小鼠尾巴,轻轻往外拽。这种固定方法,小鼠可以在盒子里面活动,固定的也不是很牢固,但足以用来注射了。还有的固定方法就是用实验室用50 mL离心管,在盖子上破一个洞,可以让小鼠的尾巴伸出来(中间的小孔可以用胶布缠一下,防止锐利的边缘割伤小鼠尾巴),然后在管壁上破几个孔用来透气。如果小鼠比较小可以在里面放一团脱脂棉。用的时候用宽胶带固定在操作台(管口在桌沿)即可,一般拎着鼠尾放在管口小鼠都会进去的。而且可以用来固定在铁架台上,方便操作。
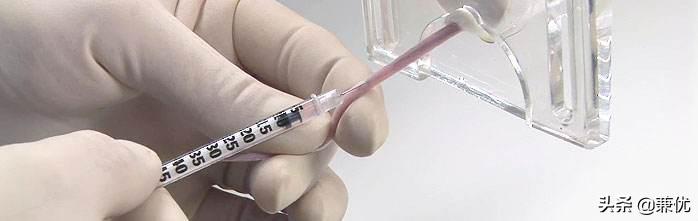
2.固定好小鼠后就是注射了,一般用一次性的1 mL的注射器就行,玻璃的1 mL的注射器也可以用,针头用4号的(不要用1ml注射器配套的针头,太大了!)。建议选用胰岛素注射针,可按需选择。

BD胰岛素针
3.注射前首先要让小鼠的血管充盈。可以采用75%的酒精棉球擦拭的方法或者采用温水浸泡的方法。若小鼠的血管很不清楚,推荐采用温水浸泡的方法,水温以不烫手为宜。温水浸泡2~3分钟后,取出小鼠尾巴,用干棉球擦拭。待血管充盈后,酒精棉球擦拭后就可以进针了。若血管还不充盈,可以反复用温水浸泡,切不可冒险盲目注射。
4.小鼠鼠尾有三条静脉,左右两侧及背部各一条,腹侧的那条是动脉。如尾静脉注射的话,左右两侧的静脉比较固定而多采用。一般要求进针部位靠近小鼠的尾端,这样若注射失败的话,还可以再向上选择进针点。但是进针部位也不可以太靠下,因为越往下,静脉越细,操作越难,一般以小鼠尾巴下三分之一的位置。
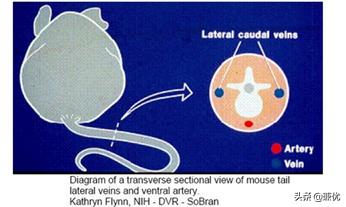
小鼠尾部左右两侧的静脉和腹侧的动脉
5.进针时操作者左手食指和拇指固定住小鼠的尾巴,让小鼠的尾巴在经过拇指后向下弯曲,进针点靠近拇指指甲。针头和血管呈约30°角,针尖斜面朝上,轻轻挑刺入皮肤后针头立即和血管平行,一般情况下,一次就可以进入血管,可将针头刺入血管一大半,左右轻轻晃动针头,确定针头在血管内,就可以推注药液了,推注的过程应该没有明显阻力,血管也不会鼓起,为进针成功。推液时动作宜轻柔,若发现血管鼓起,那是针头没有刺入血管,需立即拔出针头。
,




