气体摩尔体积
1、影响物质体积的因素:
物质是由微粒构成的,而影响物质体积的因素,主要有微粒的大小,微粒的多少,以及微粒间的距离。
研究1mol物质的体积时,由于微粒数一定,
对于固体和液体物质,由于微粒之间的距离很小,因而固体和液体物质的体积主要取决于微粒本身的大小;
对于气体物质,由于微粒之间的距离比微粒的直径大得多,(平均距离超过分子直径的10倍,分子的大小可以忽略不计),因此气体物质的体积取决于分子间的平均距离。
2、气体摩尔体积:
1811年意大利化学家阿伏伽德罗提出一条假说,后经大量实验证实为定律,内容是:在相同的温度和压强下,等体积的任何气体都含有相同数目的分子。
因为各种气体在一定相同的温度和压强下,分子之间的平均距离几乎是相等的,故1mol不同气体物质的体积就大致相同。
我们把一定温度和压强下,单位物质的量的气体所占的体积称为气体摩尔体积,用Vm表示,单位为L/ mol。
在标准状况下,1mol任何气体(纯净或混合气体)的体积约为22.4L,固标况下,气体的摩尔体积约为22.4L/ mol。
注意:
(1)标况指温度0℃压强101Kpa,常温为20℃,常压为101Kpa;
(2)气体摩尔体积仅仅是针对气体(混合气体)而言,需要注意该条件下物质的状态;
(3)气体分子之间的距离的与温度、压强有关,温度升高、压强减小,气体分子之间的距离增大,故气体的摩尔体积也与温度、压强有关,不同条件下,气体的摩尔体积不同,标况下约为22.4L/ mol;
(4)物质的量和气体体积之间的关系为:n = V / Vm,讨论到气体的体积的时候,一定要注意状态,如果没有状态,这个气体的体积是毫无意义的。
3、阿伏伽德罗定律及其推论:
理想气体方程(补充):忽略气体的体积以及气体分子之间的作用力,这样的气体称为理想气体,高中阶段气体一般都作理想气体处理。理想气体方程如下,可用于阿伏伽德罗定律推论的推导:p V = n R T
p:压强;V:体积;n:物质的量;R:常数8.314;T:温度
阿伏伽德罗定律:在同温同压下,相同体积的任何气体都含有相同的分子数
阿伏伽德罗定律的重要的推论:
推论1:同温同压气体体积比等于其物质的量比

推论2:同温同压气体密度比等于其摩尔质量(式量)之比
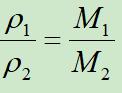
推论3:同温同体积气体压强之比等于其物质的量之比

推论4:同温同压同质量气体的体积之比等于摩尔质量的反比
推论5:同温同体积同质量气体的压强之比等于摩尔质量的反比
4、气体的相对密度及混合气体的平均摩尔质量:
相对密度:相同条件下,两种气体的密度之比称为相对密度。如A气体对B气体的相对密度用DB表示为:

混合气体的平均摩尔质量(平均相对分子质量):
设某气体混合物组分分别为A、B、C……,它们的相对分子质量依次为MA、MB、MC……,它们在混合物中所占的物质的量分数分别为xA、xB、xC……,则此混合物的平均相对分子质量为:MA*xA MB*xB MC*xC…

注意:相同条件下,液体混合,体积发生变化,气体混合,体积直接相加。
评价:气体摩尔体积是高中重要的基础知识,将气体的体积和物质的量挂钩,涉及到的知识点都是比较重要的,尤其是标况下气体的摩尔体积以及阿推公式的运用,最后,看到气体的体积,第一反应是去找状态,没有标明状态的体积是无意义的。
,




