初中化学人教版下册第九单元溶液学习内容清单(点击蓝字可查看微课视频)
一、溶液的形成
1.溶液的形成、溶液、溶质、溶剂
(1)把少量蔗糖放进水里搅拌,蔗糖不见了,水却变甜了。这是为什么呢?原来,蔗糖表面的分子在水分子的作用下分散到了水分子中间,形成了一种混合物——蔗糖溶液。蔗糖溶解在了水里,像蔗糖这样被溶解了的物质叫做溶质;溶解其它物质的物质(例如水)叫做溶剂。
(2)溶液具有均一性和稳定性。向蔗糖溶液中加入少量食盐搅拌,食盐不见了。这是因为食盐也分散到了水分中间形成了食盐溶液,不过食盐在水溶液中是以氯离子和钠离子的形式存在的。这说明,一种溶液中,溶质可以是一种物质,也可以是几种物质。像这样一种或几种物质分散到另一种物质里,形成均一的、稳定的混合物,叫做溶液。溶液中各个部分的浓度相同,只要温度不改变,水分不蒸发,溶质和溶剂也不会分离开来。所以溶液具有均一性和稳定性。
2.饱和溶液、不饱和溶液
向溶液中继续加入食盐,搅拌,食盐溶解;再加入食盐,搅拌,有少量食盐不能继续溶解;继续添加食盐,食盐不溶解。这种不能继续溶解食盐的溶液叫做食盐的饱和溶液;前面还能继续溶解食盐的溶液,叫做食盐的不饱和溶液。
取少量该食盐的饱和溶液加入少量蔗糖搅拌,蔗糖溶解,说明食盐的饱和溶液对于蔗糖来说是不饱和溶液。也就是说,某溶质的饱和溶液中还能继续溶解其它溶质。继续向食盐的饱和溶液中加水搅拌,发现剩余的食盐溶解;继续加少量食盐搅拌,食盐又溶解,这说明饱和溶液和不饱和溶液是能够相互转化的。不饱和食盐溶液中加入食盐就变成饱和溶液;饱和溶液中加水,就变成不饱和溶液。很多物质的溶解性受温度影响很大,所以改变温度也能让饱和溶液和不饱和溶液互相转化。
因此,我们所说的饱和溶液、不饱和溶液,必须是指在一定温度下,一定量的溶剂里。否则,饱和不饱和就没有意义。
在一定温度下,向一定量的水里加入某种溶质,当溶质不能继续溶解时,所得到的溶液叫做这种溶质的饱和溶液;还能继续溶解的溶液,叫做这种物质的不饱和溶液。
向食盐的饱和溶液中加入少量蔗糖,搅拌,蔗糖溶解。这说明,某种物质的饱和溶液,对于另一种溶质来说不一定饱和。
3.影响物质溶解性的因素
向一定量的水中加入一小粒碘,震荡,发现碘几乎不溶解;向一定量的汽油中加入一小粒碘,震荡,发现碘溶解在汽油里,形成棕色溶液。向一定量的水里加入少量高锰酸钾,震荡,发现高锰酸钾溶解,形成紫红色溶液;向一定量的汽油中加入少量高锰酸钾,震荡,发现高锰酸钾几乎不溶解。
这说明,同一种物质在不同溶剂中溶解性不同,不同物质在同一溶剂中溶解性也不同。所以,影响物质溶解性的因素有两个:溶质的性质和溶剂的性质。
4.溶质和溶剂
水是最常用的溶剂,汽油、酒精等也可以作溶剂。溶质可以是固体,也可以是液体或气体。如果两种液体互溶,一般把量多的一种叫做溶剂,量少的一种叫做溶质。如果其中一种是水,不管水的量多或少,一般把水叫做溶剂。
一般情况下,在不指明溶剂的溶液中,溶剂是水;如果溶剂不是水,一定要指明溶剂。
5.溶解时的吸热或放热现象
探究固体氯化钠、硝酸铵、氢氧化钠溶于水时吸热还是放热,设计方案——进行实验——得出结论。
物质溶解时常常伴随热量的变化,有些物质溶于水吸热,有些物质溶于水放热,有些物质既不吸热也不放热。
二、乳化现象
乳浊液、悬浊液、乳化作用:
向一支试管中加入少量水,滴加几滴植物油,发现水和植物油分层。用力震荡试管,得到乳状液体,这种液体里分散着不溶于水的、由许多分子集合而成的小液滴。这种小液滴分散到液体里形成的混合物叫做乳浊液。乳浊液不稳定,静置后又分为上下两层。
向试管中滴入几滴洗涤剂,震荡。形成比较稳定的乳浊液,静置后不再分层。原来,洗涤剂能使植物油在水中分散成无数细小的液滴,而不聚集成大的油珠,从而使油和水不再分层,所形成的乳浊液稳定性增强。这种现象叫做乳化。乳化后植物油形成的小液滴能随水流走,因此洗涤剂能够清洗油污。
把少量泥沙放入水中搅拌,也得到浑浊的液体。这种液体里悬浮着很多不溶于水的固体小颗粒,使液体呈现浑浊状态,这种液体叫做悬浊液。悬浊液不稳定,静置后固体小颗粒会沉降。
敲黑板:
1.乳浊液中悬浮的是液体小颗粒;悬浊液中悬浮的是固体小颗粒;
2.乳化作用是将不溶于水的液体分散成极细小的小液滴,但不是溶解;
3.溶液中溶质粒子的直径小于1nm;悬浊液和乳浊液中,粒子的直径大于100nm.
三、溶解度、溶解度曲线
1.固体物质的溶解度、气体物质的溶解度、溶解度曲线
(1)之前的实验中有这样的现象,当氯化钠溶液达到饱和状态后,继续添加氯化钠,氯化钠不能继续溶解。这说明,一定温度下,一定量的溶剂中,物质溶解的量是有限度的,其最大值就是达到饱和状态时所溶解的溶质的质量,化学上用溶解度来表示这个限度。
固体物质的溶解度:固体的溶解度表示在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量。(如果不指明溶剂,通常所说的溶解度是指物质在水里的溶解度)。例如,在20度时,100g水里最多溶解36g氯化钠(这时溶液达到饱和状态),我们就说在20度时,氯化钠在水里的溶解度是36g。
(2)20度时,氯化钠的溶解度为36g,可表示的意义:20度时,100g水里溶解36g氯化钠就达到了饱和;20度时,100g水里最多溶解36g氯化钠;20度时,136g氯化钠饱和溶液中,含有100g水和36g氯化钠。
(3)温度不同,物质的溶解度也不同,因此在说物质的溶解度之前,一定要先指明温度。
2.溶解度曲线
物质在不同温度下有着不同的溶解度,用纵坐标表示溶解度,横坐标表示温度,可画出物质的溶解度随温度变化的曲线——溶解度曲线。
(1)绘制硝酸钾的溶解度曲线
作用:利用溶解度曲线,我们可以查出某物质在不同温度时的溶解度;可以比较不同物质在同一温度时溶解度的大小;可以比较不同物质的溶解度受温度变化影响的大小;可以看出物质的溶解度随温度变化的规律等等。
(2)几种常见物质的溶解度曲线
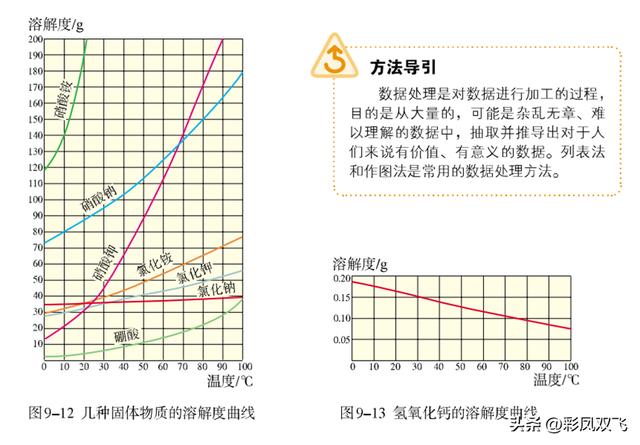
(3)总结:多数固体物质的溶解度随温度的升高而增大,如硝酸钾、氯化铵等;少数固体物质的溶解度受温度变化的影响很小,如氯化钠;极少数固体物质的溶解度随温度的升高而减小,如氢氧化钙。
3.溶解度及溶解度曲线练习题。
例题1:

例题2:

例题3:

例题4:
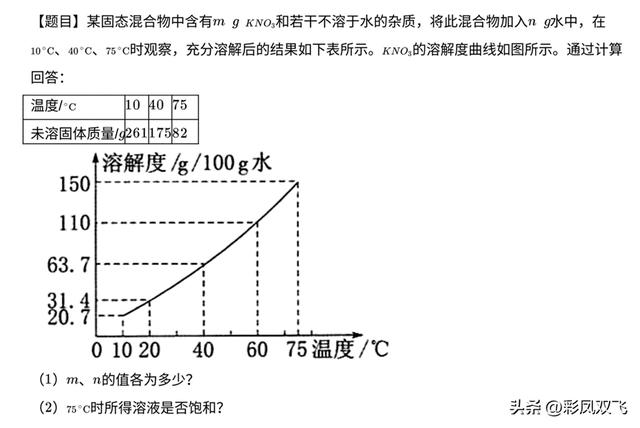
4.气体物质的溶解度
气体的溶解度是指该气体的压强为101kPa和一定温度时,在1体积水里溶解达到饱和状态时的气体体积。如氮气的压强为101kPa和温度为0度时,1体积水里最多能溶解0.024体积的氮气,则在0度时,氮气的溶解度为0.024.
气体的溶解度随温度的升高而减小,随压强的增大而增大。
5.单位
固体的溶解度是某温度下,100g溶剂中最多溶解溶质的质量,所以单位是g;气体的溶解度是1体积水里能溶解气体的体积,是体积比,所以没有单位。
6.结晶
如果给饱和的硝酸钾溶液降低温度,硝酸钾的溶解度减小,过多的硝酸钾会从溶液中以晶体的形式析出,这一过程叫做结晶。
四、与溶液有关的计算:
1、溶液、溶质与溶剂
溶液由溶质和溶剂两部分组成,所以在计算中有这样的关系:
溶液的质量=溶质的质量 溶剂的质量
由此可以推出:
溶质的质量=溶液的质量-溶剂的质量
溶剂的质量=溶液的质量-溶质的质量
2、溶质质量分数
溶质的质量分数是溶质质量与溶液质量之比,计算公式:
3、溶液的稀释和配制
(1)溶液的稀释
溶液的稀释过程中,溶质的质量不变。即:
稀释前溶质的质量=稀释后溶质的质量
根据这一相等关系,列出方程可进行计算。
(2)溶液的配制
这里所说溶液的配制指的是用两种不同浓度的溶液,配制出中间浓度的溶液。例如用10%的氯化钠溶液和3%的氯化钠溶液,配制5%的氯化钠溶液。溶液的配制过程中,所取用的浓溶液中所含的溶质的质量与所取用的稀溶液中所含的溶质的质量之和等于配制后所得溶液中溶质的质量。即:
浓溶液中溶质质量 稀溶液中溶质质量=配制后溶液中溶质质量
根据这一相等关系,可列出方程进行计算。
附:
第九单元课题1溶液的形成课后练习与应用解析及答案
第九单元课题2溶解度课后练习与应用解析及答案
第九单元课题3溶质的质量分数课后练习与应用解析及答案(1-7题)
第九单元课题3溶质的质量分数课后练习与应用解析及答案(第8题)