本文来源于 “复旦大学脑科学转化研究院 ”,已授权转载


# 脑海Yeah 第 41 期 #
文 | 徐宗艺
冬奥会正如火如荼的进行着,它吸引着全球的目光。我们感动于开幕式上无数独属于中国人的浪漫,也在电视机前为替祖国争光的奥运健儿们欢呼喝彩。每位运动员所展现出的傲人的运动天赋都与其大脑中的基底神经节(Basal ganglia)密切相关,基底神经节有重要的运动调节功能,与随意运动的稳定、肌紧张的控制、本体感觉传入冲动信息的处理相关。基底神经节中不同核团间的相互投射构成了两大经典环路——直接通路和间接通路,二者的动态平衡是基底神经节执行正常生理功能的基础。当精密的平衡被打破,机体便会出现许多运动障碍,进而导致相关疾病的发生。
帕金森病(Parkinson’s disease,PD)就是一种典型的以运动障碍为主要特征的神经退行性疾病,患者不仅会出现震颤、运动迟缓、僵直等典型的运动症状,还会伴随着睡眠障碍、认知障碍等非运动症状的发生,此种疾病病程较长且难以治愈等特点极大的影响着患者的生活质量。许多人初识帕金森这种疾病,是源于拳坛传奇人物阿里在1996年亚特兰大奥运会上的一次亮相。在那届奥运会的开幕式上,患有帕金森病的拳王阿里颤抖地接过火炬。在圣火映照下,尽管老阿里行动迟缓、双手颤抖,但他的面孔却依旧坚毅,那一刻也成为了奥运会史上最感人的镜头之一。
帕金森病的早期治疗以药物治疗为主,服用低剂量复合左旋多巴(L-Dopa)即可较好的缓解患者的症状。L-Dopa为多巴胺(DA)的前体药物,本身无药理活性,该药物可以通过血脑屏障进入中枢,经多巴脱羧酶作用转化成DA而发挥药理作用。但是,一旦度过“蜜月期”,药物治疗便不再起效。
深部脑刺激(Deep Brain Stimulation,DBS)则是另一种常用的治疗PD的神经外科手术方法,该方法是由拉斯克奖得主Alim Louis Benabid发明的一种医疗方法,可以治疗脑部疾病。在帕金森病的中晚期治疗中,患者长期大量使用左旋多巴等药物,会出现异动等一系列影响日常生活的症状,这种情况下,临床医生通常会建议患者采用DBS的治疗手段,将电极植入到脑内,运用脉冲发生器刺激其大脑深部的某些核团,纠正异常的大脑放电,从而减轻病症。在帕金森病的治疗中,常用的靶点脑区为:间接通路的关键节点丘脑底核(STN)和直接与间接通路会聚后的抑制性输出最终节点苍白球内侧核(GPi)[1](图1),通常的刺激频率在130HZ左右,实际应用中会随患者实际情况进行调整。
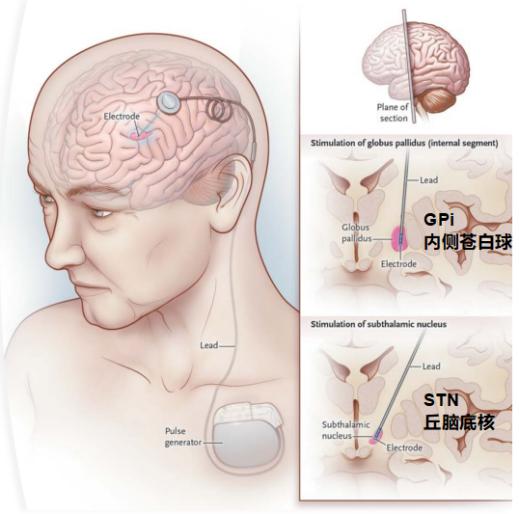
图1
传统的DBS技术是即开即起效,即关即失效的(视频1),为了长时间持续的改善患者症状,DBS电极需要长时间的工作,这对电池的寿命要求很高。因此,DBS的电池寿命也一直是研究者们努力优化的方面。除此之外,以STN和GPi为靶点的刺激虽然能够明显地改善患者的运动症状,但也存在着一些副作用,部分患者会出现非运动症状加剧的情况。大量的工作围绕这些问题展开,相关临床研究表明,基底神经节中枢脑区外侧苍白球(GPe)或许是另一重要的治疗PD的刺激靶点。有研究表明,在GPe施加高频电刺激时,帕金森患者的运动障碍缓解效果更好且起效时间更短,同时有着改善患者睡眠质量的附加作用[2-3]。
最近卡耐基梅隆大学Aryn Gittis教授实验室的系列工作为向我们展示了一种全新的PD治疗方法,他们发现“burst”模式的刺激能够持续改善多巴胺耗竭小鼠(dopamine-depleted mice, DD mice)的运动障碍,既达到的省电的目的,也极大的降低了传统刺激模式下患者对DBS的依赖性。前期的研究中,研究人员利用光遗传学刺激的方法分别对GPe整体以及间接通路(D1-ChR2)进行光刺激,结果发现刺激D1-ChR2可以挽救DD小鼠的运动障碍,而整体刺激GPe却并不起效。这一结果提示了以GPe为核心的环路在DBS中的重要作用(图2)。

图2
GPe是一个神经元种类繁多的核团,研究人员进一步将目光聚焦于两类分子marker不同的 GABA能神经元——Lhx6 和PV 的神经元,发现这两类神经元对于光刺激的响应是相反的。他们在PV-GPe或Lhx6-GPe神经元中表达光敏离子通道,这些通道接受特定波长的激光照射时会抑制或增强神经元的活动。通过向小鼠大脑中植入光导纤维,研究人员可以精确控制PV-GPe或 Lhx6-GPe神经元的活性。他们发现分别激活GPe中的PV 神经元或者抑制Lhx6 神经元都能够很好的缓解DD小鼠的运动障碍(图3),并且能够在刺激结束后持续的起效,而同时激活PV-GPe和Lhx6-GPe神经元并不能减轻相关症状。进一步对机制探究的结果显示,DD mice 运动障碍缓解的关键是PV-GPe神经元和Lhx6-GPe神经元之间活性的差异,当PV-GPe神经元的活性大于Lhx6-GPe神经元时,其症状就会得到减轻(图4)。同时,在这份研究中,研究人员采用的是有时间间隔光刺激——“brief pulses”(pulse width = 5 ms, 10 Hz, 120 pulses / pulse width = 30 s, interpulse interval = 3 min, 10 pulses),在光刺激结束后,DD小鼠能够保持长达4个小时的运动缓解,这一表现也显著长于目前的其它疗法[4]。

图3

图4
光遗传学手段目前只能在小鼠模型中使用,因此研究人员以此为基础,发现了一种“更精确”“更聪明”的电刺激范式,其效果更为持久,从而大大减少刺激时间,既可以最大限度地减少副作用,还可以延长植入物的电池使用寿命。他们首先发现,高频电刺激下,PV-GPe和Lhx6-GPe神经元的反应是“不对称”的,并且在刺激的起始阶段(0-1s),Lhx6-GPe神经元的抑制性电流显著高于PV-GPe神经元,Lhx6-GPe和PV-GPe神经元之间的差异在长时间刺激的最初1s也最为显著(图5)。他们因此推测短时间的刺激,而非传统的持续刺激,可以在GPe中实现PV 和Lhx6 这两类神经元的特异性神经调节。为了确定使PV-GPe和Lhx6-GPe神经元产生相反响应的刺激参数,研究人员使用了一种迭代的机器学习方法,最终确定了175HZ,200ms的高频、短时的“burst”刺激范式(图6)。

图5

图6
接下来他们进一步探究GPe中不同类型神经元对这种“burst”电刺激产生不同响应的原因。GPe分别接受来自STN的兴奋性投射以及来自纹状体D1-MSN和D2-MSN的抑制性投射,考虑到刺激电极的位置(接近GPi),他们认为电刺激可能更多的激活了直接通路(D1-MSN → GPi)。利用光遗传学的手段对这一假设进行验证,发现GPe-PV和GPe-Lhx6神经元对D1-MSN传入的光遗传刺激响应是不同的,这一刺激极大的抑制了GPe-Lhx6神经元,而并未抑制PV-GPe神经元(图7),进一步的化学遗传学阻断也证实了这一假设(图8)。

图7

图8
最后,研究人员利用向内侧前脑束(medial forebrain bundle , MFB)注入6-OHDA的方法制作了DD小鼠模型,从整体动物层面验证了“burst”刺激模式的有效性。实验结果显示,与传统刺激模式相比,采用经过改良的新型深部脑刺激方法,对DD小鼠提供治疗效果的持续时间远远超过了传统方法,平均延长了4.5倍(图9、视频2)[5]。

图9
深部脑刺激的临床治疗专家,匹兹堡大学的Donald Whiting医生认为这种深部脑刺激的新方法有望为实验性治疗打开大门。Aryn Gittis教授实验室的研究人员也正在积极地把动物模型上取得的结果转化为临床治疗方法,相信在不久的将来,全新的帕金森病治疗方法将会走入我们的视野。
(End)
参考文献
[1] Okun MS. Deep-brain stimulation for Parkinson's disease. N Engl J Med 2012;367:1529-1538
[2] Vitek J L, Hashimoto T, Peoples J, et al. Acute stimulation in the external segment of the globus pallidus improves parkinsonian motor signs[J]. Movement Disorders, 2004, 19(8).
[3] Dong J, Hawes S, Wu J, et al. Connectivity and Functionality of the Globus Pallidus Externa Under Normal Conditions and Parkinson's Disease[J]. Frontiers in neural circuits, 2021, 15:645287.
[4] Mastro K J, Zitelli K T, Willard A M, et al. Cell-specific pallidal intervention induces long-lasting motor recovery in dopamine-depleted mice[J]. Nature Neuroscience, 2017.
[5] Teresa Spix et al. Population-Specific Neuromodulation Prolongs Therapeutic Benefits of Deep Brain Stimulation. Science, 2021. (本文原文
,




