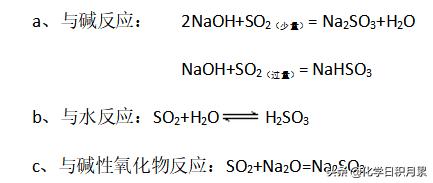往期链接:点击直达
8、高三化学总复习,钠及其化合物的性质
9、高三化学总复习,铝及其化合物,此元素较复杂,难题都有它
10、高三化学总复习,铁及其化合物,绝对最重要的元素
11、高三化学总复习,硅及其化合物,琐碎的知识点较多
12、高三化学总复习,氮及其化合物,又一个明星元素,重要
一、硫及其化合物1、硫单质

2、二氧化硫
1)、SO2的物理性质
无色、有刺激性气味的有毒气体,密度比空气大,易溶于水(常温常压下,1体积水大约溶解40体积的SO2),易液化。
2)、SO2的化学性质
- (1)、具有酸性氧化物的通性(亚硫酸的酸酐)。
- (2)、二氧化硫中硫元素的化合价为 4,处于中间价态,在反应中既可作氧化剂,也可作还原剂。
- (3)、漂白性:SO2可使品红溶液褪色,体现了SO2的漂白性。
3、硫酸
1、硫酸的物理性质
无色、油状液体,密度比水大,难挥发,沸点高。
2、硫酸的化学性质
1)、稀硫酸具有酸的通性。
2)、浓硫酸的特性:
- (1)、吸水性
浓硫酸能吸附物质中湿存的水分。
H2SO4(浓) nH2O = H2SO4·nH2O
利用此性质可用浓硫酸作干燥剂,干燥一些不与浓硫酸反应的气体,通常用于洗气装置。如可用浓硫酸干燥O2、H2、CO2、Cl2、HCl、SO2、CO、CH4、C2H2等气体。
注意 浓硫酸不能干燥碱性气体和具有较强还原性的气体。
- (2)、脱水性
指浓硫酸将有机物里的氢、氧元素按原子个数比2∶1脱去生成水的性质。例如:
- (3)、强氧化性
常温下,Fe、Al遇浓硫酸会发生钝化现象。但热的浓硫酸能氧化大多数金属、非金属单质及一些还原性化合物。例如:
在这些氧化还原反应中,硫酸的还原产物一般为SO2。
4、几种重要的硫酸盐
注意 BaCO3、BaCl2等钡盐有毒。BaCO3不可用作"钡餐",BaCO3虽然不溶于水,但能溶于酸,在人的胃中BaCO3能与胃酸反应生成Ba2 而使人中毒。
5、SO42- 、SO32- 的检验
1)、SO42-的检验
检验SO42-时会受到许多离子的干扰。
- (1)、Ag 干扰:先用盐酸酸化能排除Ag 的干扰,因为Ag Cl-=AgCl↓。
- (2)、CO32- 、SO32- 、PO43- 干扰:BaCO3、BaSO3、Ba3(PO4)2也是白色沉淀,与BaSO4白色沉淀所不同的是这些沉淀能溶于强酸。因此检验SO42时,必须用盐酸酸化(不能用HNO3酸化,因为SO32-会被HNO3氧化)。不能选用Ba(NO3)2溶液,因为在酸性条件下,SO32-、HSO32-、SO2等会被溶液中的NO3-氧化为SO42-,从而干扰原溶液中SO42-的检验。检验SO42-的正确操作为:
2)、SO32-的检验
- 向溶液中加入盐酸,将产生的气体通入品红溶液中,红色褪去;或加入氯化钡溶液生成白色沉淀,加入盐酸,沉淀溶解并产生无色具有刺激性气味的气体。
二、环境污染与保护
1、环境污染:
主要包括大气污染、水污染、土壤污染等,还包括固体废弃物、放射性、噪声等污染。酸雨是造成环境污染的罪魁祸首之一。
1)、酸雨
大气中的二氧化硫和二氧化氮等溶于水后形成酸性溶液,随雨水降下,就可能成酸雨,其pH小于5.6。
2)、硫酸型酸雨的形成途径
- ①、空气中飘尘的催化作用,使空气中的SO2发生反应:
- ②、SO2 H2O= H2SO3 2H2SO3 O2= 2H2SO4
3)、酸雨的危害:
直接破坏农作物、森林 、草原,使湖泊酸化,加快建筑物的腐蚀。
4)、酸雨的控制措施:
- a、调整能源结构;
- b、原煤脱硫;
- c、改进燃烧技术;
- d、对煤燃烧后的烟气脱硫;
- e、开发氢能、风能、太阳能等清洁能源;
- f、严格控制SO2的排放等。
2.空气质量监测
空气质量日报的主要内容包括"空气污染指数"、"空气质量级别"、"空气质量状况"、"首要污染物"等。目前计入空气污染指数的项目暂定为:二氧化硫、一氧化碳、二氧化氮、可吸入颗粒物和臭氧等。
往期链接:点击直达
8、高三化学总复习,钠及其化合物的性质
9、高三化学总复习,铝及其化合物,此元素较复杂,难题都有它
10、高三化学总复习,铁及其化合物,绝对最重要的元素
11、高三化学总复习,硅及其化合物,琐碎的知识点较多
12、高三化学总复习,氮及其化合物,又一个明星元素,重要
如果您喜欢,可以收藏、点赞加关注,您的支持,是我继续推出文档的动力!
网页版,排版不太好,想要文字word文档的,请私信我!,