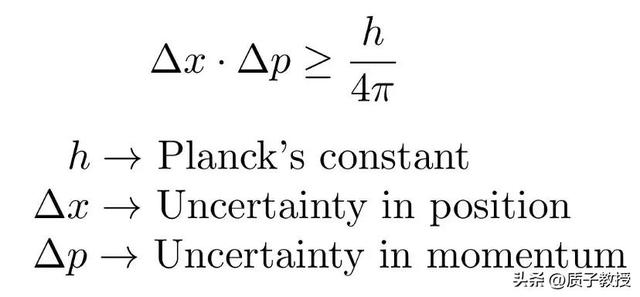我们都知道,电子带负电,原子核带正电,按照正负电相互吸引的原则,电子应该会坠落到原子核上,但事实上并没有,为什么?
简单讲,我们不能用宏观世界的思维方式去衡量微观世界,也就是说,宏观世界的经典力学到了微观世界就不适用了。

微观世界有自己的一套物理定律。
按照海森堡不确定性原理,我们无法同时确定微观粒子的位置和速度(动量)。测量到的粒子位置越精确,它的速度就越不精确。
如果电子坠落到了原子核上,就意味着电子的位置和速度就可以同时准确测量到,显然这违反了不确定性原理。

微观粒子的不确定性,用公式表达就是ΔxΔp≥h/4π。
公式中h是普朗克常数,Δx是微观粒子的位置不确定量,Δp是微观粒子的动量不确定量,两者的乘积必须不小于一个常数,这个常数非常小,但无论多小都比零要大。
微观世界为什么拥有如此规律?
目前我们不得而知,我们只知道存在这样的规律,不知其中更深层的原因。
还有,很多人会认为电子与原子核的关系就像地球与太阳的关系那样,实际上两者相差很大。

严格来讲,电子并不是围绕原子核运转,而是以概率云的方式随机出现的原子核外围,出现在不同的能级轨道上,电子只能在不同的能级轨道之前来回跃迁。
内层轨道能量更小,外层轨道能量大。如果电子吸收特定量的能量(也就是光子),就会从内层轨道跃迁到外层轨道。反之,如果电子向外辐射出特定量的能量,就会跃迁到内层轨道。

吸收或者辐射的能量必须正好是不同能级的能级差,电子才能发生跃迁,否则就不会跃迁。说白了,电子必须严格地在不同的能级上来回跃迁,而不能位于不同能级之间的位置。
这也是为什么电子不会坠落到原子核上面的原因之一。
当然,也并不是说电子一定不会坠入到原子核上面,只要施加给电子足够大的能量,的确可以坠落到原子核上。

这就牵扯到泡利不相容原理了,这个原理表明,不允许两个或者两个以上的微观粒子处在完全相同的状态,如果两个粒子在外力作用下试图处于这样的状态,就会产生一种压力来抵抗外力,这就是电子简并压。
而如果外力足够强大,电子简并压也抵抗不了,最终电子坠落到原子核上,与质子结合成中子,这就是中子星的形成方式!
,