- 文件控制是质量管理体系的核心
ISO 13485标准或者我们的医疗器械生产质量管理规范GMP都要求医疗器械企业建立质量体系,而质量体系的体现就是通过文件形式来呈现;不管是药监部门对企业的注册体系或生产许可审查,还是公告机构对企业的审核,绝大部分是看企业的文件和记录。其次,企业需要制定质量体系,用来指导和规范各个过程的进行,使得企业在运转过程中是有“法”可依的。
- 质量体系要求的文件类别
企业的质量管理体系通常包括以下文件:
- 程序文件(第二阶文件)
- 管理制度(第三阶文件)
- 操作规程(第三阶文件)
- 检验规程(第三阶文件)
- 作业指导书(第三阶文件)
- 外来文件(第三阶文件)
- 质量记录(第四阶文件)
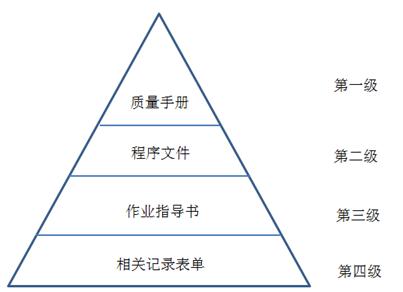
质量体系结构图
- 文件的基本框架
如何识别一个企业文件,也是文件的唯一性如何来区别?一般,我们可以在文件封面或第一页上看到以下的内容:
- 文件编号
- 文件版本
- 文件名称
- 文件生效日期
- 文件编制、审核和批准的人员和日期
- 文件的修订历史记录

文件封面样版
文件具体内容结构:
- 目的
- 适用范围
- 职责和权限
- 具体流程
- 文件管理的流程
文件的管理流程包括文件的编制/修改、审核、批准、发放、变更、作废和销毁这些过程。
任何文件在建立或者更改时,文件变更提出人都需要提交文件的建立或变更的申请,这个变更的申请需要将所要变更的文件的唯一性内容描述清楚,比如本文第3点所提到的文件名称、编号、版本等内容;同时描述清楚所需要更改的具体内容,比如之前的内容是什么,更改后的具体内容是什么;以及为什么要进行变更。
在变更申请上述内容填写后,此变更申请需要提交文件所涉及的部门或人员进行评审和审核,特别是涉及到产品质量相关的文件,比如产品主文档中的关于产品的作业指导书、技术要求等等文件。
不同级别的文件编制、审核和批准人员不同,这些相应的权限也需要在文件中进行规定,使得操作起来有依据可遵循。比如:
- 质量手册由质量部负责组织编写,由管理者代表进行审核,总经理批准。
- 程序文件由各部门相关责任人编写,部门负责人进行审核,管理者代表批准。
- 作业指导书等三阶文件由各部门相关责任人组织编写、汇总,工程师进行审核,部门负责人批准。
文件批准后,需进行受控并发放。一般企业都是在文件上盖上受控印章。
文件发放时需要填写发放记录,同时将旧版本的文件收回,对旧版本的文件需至少保留一份作废文件,以备后续的追溯查询。
作废文件的保存期限也需要在文件中规定,但是作废文件保存期限不能比产品的寿命期短。
以上内容是本人关于医疗器械质量体系关于文件管理的一些认知,大家有什么问题可以一起交流、沟通。
视频链接:也可参考关于此内容的视频。
,




