导·读
腹腔镜胆囊切除术(LC)时腹腔内视野的建立方法有注入CO2的气腹法和腹壁悬吊法。两种方法各有千秋,应灵活使用。
气腹法
➤ 气腹法的腹腔穿刺
患者取15Trendelenburg体位,于脐下1.5cm处弧形切开皮肤,分离皮下组织,显露腹直肌鞘,并用两把Kocher钳将其提起,于两钳之间以Verres气腹针穿刺腹腔【图1】。穿刺时要注意表示顶端组织抵挡指示器的变化,并用左手握住Kocher钳。通过生理盐水注入试验来判断穿刺针是否位于腹腔内【图2】,没有血液逆流、注入生理盐水没有阻力、拔除注射器后穿刺针内的生理盐水被迅速吸入腹腔,即可判断穿刺针位于腹腔内。接着,连接气腹机,开始以低速注入CO2。待腹腔内压达1~2mmHg时,确认穿刺针位置良好后,切换成高速注气。如果腹腔内压很快升至5mmHg以上,则可能是穿刺针位置不当,应重新穿刺。重新穿刺还不能纠正时,应立即采取小切口开腹。另外,腹腔内压在3mmHg左右时,穿刺针顶端可能抵住大网膜,此时可拍打腹壁或将穿刺针稍稍拔出少许。既往正中开腹手术的患者,可远离开切口瘢痕,作小切口进腹,直视下插入Trocar,接着行气腹操作。

图1 Kocher 钳提起腹直肌鞘,Verres气腹针穿刺腹腔
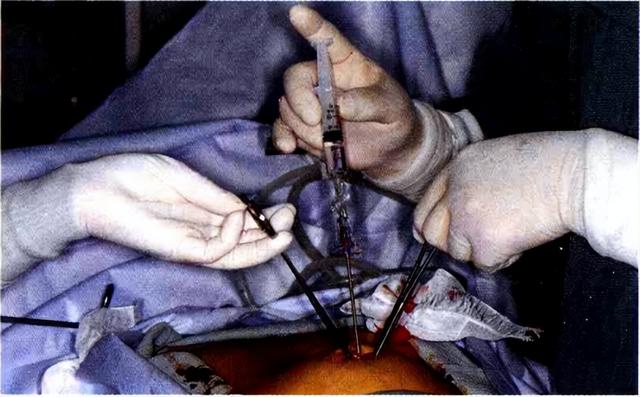
图2 生理盐水注入试验
➤ 气腹法的并发症
气腹针、Trocar穿刺可能带来的并发症包括大血管、肠管损伤等严重问题。据报道,气腹腹腔镜手术的并发症主要是皮下气肿和通气功能障碍,这是因为在早期腹腔镜手术时将腹腔内压设定过高。气腹对循环呼吸有一定的影响,通常将腹腔内压设定在8mmHg,对循环呼吸影响不大。但对高龄患者和心脏功能有问题的患者,将腹腔内压降到6mmHg较好。
➤ 要点与盲点
- 气腹针穿刺时,手术感觉针尖阻力,注意指示器的变化,在脐附近进行穿刺。
- 对呼吸循环系统有风险的患者,可设定低腹腔内压(5~6mmHg)。
- 腹壁悬吊时要注意钢丝穿刺部位(胸骨前)、Trocar位置和麻醉中的肌松状态。
腹壁悬吊法
悬吊法可分为皮下悬吊法和腹壁全层悬吊法,已有特制的器械。悬吊法的优点是吸引、缝合、结扎等操作的感觉与开腹手术完全一样。悬吊器械如图3所示。
方法是:于脐上缘和右肋缘的皮下分别穿过1根钢丝(直径1.2mm),套在手柄上,向上提起,然后固定在支架上,也不费多少时间。皮肤和胸壁在中线连接最紧密,因此,右肋缘皮下的穿刺应尽量靠近中线,这样可获得良好的视野。
通常在气腹下行LC,只在急性胆囊炎和胆总管结石手术时应用悬吊法。急性胆囊炎的分离操作免不了有些出血,出血后定向感差,而且需不停地吸引,若在气腹下手术,视野很差,需反复充气,延长了手术时间。应用悬吊法,即使不停地吸引,也不会对视野造成影响,不妨碍分离操作,这样就可缩短手术时间。
另外,胆囊壁肥厚时,分离胆囊床可产生大量烟雾,影响操作。此时,若用带吸引器的电刀,边吸引边分离,手术就显得相当顺利。胆总管切开时应用悬吊法的优点是可以和开腹手术一样,使用胆道手术器械(取石钳、胆道镜、持针器等)。取石和缝合操作的感觉也同开腹手术一样,确实能缩短手术时间。

图3 腹壁悬吊的器械
小结
气腹法尽管能保证腹腔内有较开阔的视野,但术中产生的烟雾会妨碍视野。悬吊法的缺点是腹腔内视野和钳子操作性比气腹时差,特别是术者的感觉。在了解了两种视野制作方法的优缺点后,灵活使用非常重要。
作者:姚小晓, 盛基尧, 张学文
文章来源:国际外科学杂志, 2022, 49(4)
摘 要
近年来,组织学证实了Laennec包膜的存在,发现Laennec包膜间隙可以作为解剖性肝切除中手术分离的解剖入路。随着外科医师对肝脏手术认识的加深,Laennec包膜在解剖性肝切除手术中的地位必将日益凸显,认识、重视、利用Laennec包膜,有助于解剖性肝切除手术规范化,推动解剖性肝切除手术向更加精准、更加安全的方向发展。本文对Laennec包膜作一系统介绍,并结合笔者在肝脏手术中相关的经验,总结Laennec包膜在入肝血流阻断和肝实质离断这两个解剖性肝切除的关键技术中的应用,发现通过Laennec包膜与肝蒂及肝静脉之间的潜在间隙作为手术分离入路可以避免肝实质的破坏,减少出血,简化手术步骤,缩短肝门阻断时间和手术时间。
法国Laennec医师对人类医学的发展做出了巨大贡献,他发明了听诊器,还被誉为胸腔内科之父、现代呼吸病学奠基人以及现代诊断学奠基人。他在1802年发现并提出了肝脏"Laennec包膜"的概念,但在当时并未得到重视,随着手术技术的发展,人们对肝脏解剖结构的再认识,以及解剖性肝切除理念的提出并被广泛接受,发现通过Laennec包膜与肝蒂及肝静脉之间的潜在间隙作为手术分离入路可以避免肝实质的破坏,简化手术步骤,提高手术效率并增加手术安全性。
本文对Laennec包膜作一系统介绍,并结合笔者在肝脏手术中的相关经验,总结Laennec包膜在入肝血流阻断和肝实质离断这两个解剖性肝切除的关键技术中的应用,希望有更多肝脏外科同道认识、重视、利用Laennec包膜,共同致力于解剖性肝切除手术规范化,推动解剖性肝切除手术向更加精准、更加安全的方向发展。
1 Laennec包膜概述
传统意义上的肝包膜指的是肝脏表面除肝裸区之外的区域表面覆盖的浆膜,头侧与肝静脉表面浆膜相连,尾侧延伸至肝十二指肠韧带表面。在1802年,Laennec医师就提出在肝实质与这层浆膜之间还有一层非薄膜性结构[1]。这一膜性结构将肝实质与肝包膜及进出肝脏的管道结构(肝静脉、Glisson系统)分隔开,即Laennec包膜(见封三,图1[4])。1954年,法国学者Couinaud从病理学上证明了Laennec包膜与Glisson鞘相互独立[2],但受限于肝脏外科的发展,那个时代的外科医师尚未认识到Laennec包膜对于肝脏手术的重要意义。

直到2008年,Hayashi等[3]对人类尸体肝脏采用弹性纤维和淋巴管染色,结果表明肝实质表面存在一层以纤维为主的膜性结构,再次证实了Laennec包膜的存在。
2017年,Sugioka等[4]采用Azan-Mallory染色法标记了肝脏内部及其表面各组织的肌原纤维和胶原纤维,结果表明:(1)在肝脏浆膜层和肝实质之间,有一层富含弹性纤维的膜结构附着在肝实质表面且独立于肝脏浆膜层;(2)富含弹力纤维的Laennec包膜与乏弹力纤维和平滑肌肌蛋白阴性的Glisson鞘结构明显不同,二者之间存在一定间隙,相互独立,Laennec包膜随Glissson蒂深入肝实质,将肝实质与Glisson系统各分支分隔开;(3)在胆囊切除术后的胆囊窝处同样可以观察到富含弹力纤维的Laennec包膜的存在,由此可推断Laennec包膜与由肝门板、胆囊板、脐静脉板及Arantius板组成的肝门板系统相互独立互不延续,可以作为解剖第一肝门时下降肝门板的手术入路;(4)组织学还可以在肝静脉主干和主要分支表面观察到富含弹力纤维的膜样结构,与肝静脉壁之间存在疏松结缔组织间隙,并于肝外Laennec包膜相延续。
由于以上的发现,Laennec包膜存在成为肝脏手术入路的潜在可能,使其重新回到肝脏外科医师的视野,从尘封的角落回到了外科手术舞台的中央。南京大学医学院附属鼓楼医院余德才团队,通过苏木精-伊红染色法和网状纤维染色,检测10个肝移植手术切除的病肝样本,测定出Laennec包膜与Glisson蒂平均间隙为(32.0±8.7) μm,Laennec包膜与肝静脉、下腔静脉之间的间隙分别是(26.0±6.3) μm和(29.0±7.0) μm[5]。
笔者单位以上述解剖发现为依据,自2020年开始在肝切除手术中使用Laennec包膜作为解剖标记,已完成开腹及腹腔镜解剖性肝切除70余例,包括左半肝切除、右半肝切除、肝右前叶切除、肝右叶切除、中肝叶切除等,发现在分离肝蒂和显露肝静脉的过程中可明显减少出血、简化手术步骤,手术时间、肝门阻断时间等均较之前明显缩短。
2 Laennec包膜在解剖性肝切除肝蒂分离中的应用
随着时代的发展,医学界对肝脏疾病本身和肝脏手术的认识不断加深,解剖性肝切除在肝脏恶性肿瘤的手术治疗中的优势被广泛地认可。它是基于Couinaud分段理论按照门静脉灌注区域切除病变肝亚段、段、叶的肝切除方法,能够切除肿瘤及其所在区域微转移病灶,减少术后局部复发风险,改善预后[6]。
多项研究均证实解剖性肝切除可提高总体生存期及无进展生存期,Hasegawa等[7]回顾性分析210例单发肝细胞癌手术病例,与非解剖性肝切除相比,解剖性肝切除可显著改善患者五年生存率(66%比35%,P=0.01)以及无瘤生存率(34%比16%,P=0.006)。Hokuto等[8]完成包含93例肝脏单发肿瘤(肿瘤直径<5 cm)研究结果显示,与非解剖性肝切除比较,解剖性肝切除显著延长无瘤生存期,降低肿瘤复发风险。另一项研究显示,对于伴有门静脉微血管侵犯的肝细胞癌,亚肝段切除局部复发率为2.2%,远低于非解剖性肝切除的13.6%[9]。
区域性入肝血流阻断可明确肝脏预切除范围,减少全肝阻断时间,减轻剩余肝脏缺血-再灌注损伤,降低术中肿瘤经门静脉播散概率[10],是解剖性肝切除的关键技术之一,通过合适的方法路径进行第一肝门Glisson蒂处理,是手术成功与否的核心问题。Glisson蒂的阻断可分为鞘内解剖入路和鞘外解剖入路,其中鞘外解剖简单直观,尤其适合腹腔镜、机器人等微创肝脏手术中使用[11],过去鞘外解剖通常经过肝实质分离肝蒂,容易导致临近肝蒂或肝静脉的损伤。
由于Laennec包膜的存在,通过Laennec包膜间隙,使肝蒂与肝实质之间的分离变得更为简单易行。既可以避免对肝内管道进行复杂的解剖,同时最大化减少肝实质损伤,减少局部出血,尤其在腹腔镜、机器人肝切除手术中,少量的出血就可对操作视野产生巨大的影响,经Laennec包膜鞘外解剖入路能够提供干净、清晰的创面视野,充分显露Glisson蒂解剖结构,精确阻断预切除区域肝脏血流。2021年初日本举行的第32届日本肝胆胰外科学年会[12]中,大会重点推介了Sugioka等[4]提出的经Laennec包膜鞘外解剖方法,该方法基于肝门处4个重要解剖标志和6扇门理论,85.3%的与会专家均赞成Laennec包膜在肝外Glisson蒂解剖中具有非常重要的意义。
在Sugioka等[4]提出的经Laennec包膜鞘外解剖方法中,4个重要的解剖标志从左至右分别是Arantius板、脐静脉板、胆囊板及右尾状突肝蒂;6扇门是由这4处解剖标志所指示的点(见封三,图2[4]),通过这些门可以进入Laennec包膜和肝蒂之间的间隙,门Ⅰ位于Arantius板与脐静脉板交会处;门Ⅱ位于肝圆韧带与脐静脉板交界处;门Ⅲ位于脐静脉板右缘与Glisson蒂根部交界处;门Ⅳ位于胆囊板左缘与Glisson蒂根部交界处;门Ⅴ位于胆囊板右缘Rouvieres沟上方;门Ⅵ位于Rouvieres沟与右尾状突肝蒂之间。
基于Takasaki[13]提出的"肝三段解剖理论",即肝门部三支粗大的Glisson蒂主干分别进入肝内,将肝脏分为左肝段(左支)、中肝段(右前支)、右肝段(右后支),通过门与门之间的连线,找到经Laennec包膜解剖分离的路径,完成肝段、肝叶区域性阻断。通过门Ⅰ、Ⅱ间的连线可阻断肝左外叶(2段、3段)入肝血流;通过门Ⅰ、Ⅲ间连线可阻断左半肝(2、3、4段)入肝血流;通过门Ⅱ、Ⅲ间连线可阻断左内叶(4段)入肝血流;通过门Ⅳ、Ⅴ连线可阻断右前叶(5段、8段)入肝血流;通过门Ⅴ、Ⅵ连线可阻断右后叶(6段、7段)入肝血流,在此基础上再沿Glisson蒂与Laennec包膜间隙进一步向肝内解剖,分离阻断预切除部分Glisson蒂分支,完成肝段、亚肝段的解剖性切除。
笔者单位还将此解剖方法与吲哚菁绿荧光负染法相结合,通过预切除区域阻断后外周静脉注射吲哚菁绿(0.1 mg/mL,5 mL),在荧光下清晰显示预切除肝段(见封三,图3)。笔者的经验是轻度肝硬化较之正常质地肝脏和严重硬化肝脏更易寻找到Laennec包膜与Glisson蒂之间的间隙,对于部分肝硬化较重患者,有比较肥厚的肝组织覆盖肝门,可以进行局部围肝门肝组织切除之后再下降肝门板寻找Laennec包膜,只要找到正确的层次和间隙,并沿此间隙解剖,就可以在无出血状态下清晰分辨组织结构,准确处理Glisson管道。


3 Laennec包膜在肝实质离断中的应用
肝实质离断是解剖性肝切除另一个重要环节,通常依据区域阻断后缺血线结合肝脏表面解剖标志来确定断肝平面,但肝实质内缺血改变远不如肝表面明显,同时存在术中出血干扰等原因,难以保证肝内精准离断,容易出现偏离预定断肝平面的情况。断肝平面出现偏差,则可能导致意外血管损伤出现大出血,还可能造成切缘阳性或医源性肿瘤播散,不仅影响手术的顺利进行,还将影响肿瘤的治疗效果。那么如何利用准确的肝内解剖标志就非常重要,根据肝脏Couinaud分段法,肝静脉走行于肝段之间的解剖平面内,是肝段之间天然的分界线,目标肝段流入道阻断后肝表面缺血线和相应肝静脉所确定的平面即为术中需要寻找的肝实质离断平面。因此,寻找并依循标志性肝静脉走行以判断和修正断肝平面对解剖性肝切除至关重要[14]。同时,沿肝静脉主干走行时血管分支较少,主动解剖显露肝静脉可避免损伤,降低出血风险[15]。
既往术中通常使用CUSA、刮吸刀或超声刀的推、拨、刮、擦、夹等手法沿静脉边缘解剖,需要对能量器械的理解和操作非常深刻和娴熟,对手术医师的技术要求较高。认识到Laennec包膜之后,我们就可以循着Laennec包膜外的间隙显露、解剖肝静脉[16],在笔者单位通常先循肝静脉分支寻找到肝静脉主干,之后利用分离钳、吸引器等非能量器械沿Laennec包膜与肝静脉之间的间隙分离,夹闭切除侧的静脉属支,再使用能量器械离断肝实质。2018年余德才团队报道的Glisson肝蒂解剖联合肝静脉主干优先显露策略[5]、Kiguchi等[17]报道的肝静脉根部Laennec膜间入路肝Ⅶ段切除都是应用Laennec包膜与肝静脉之间间隙进行操作,在分离肝静脉过程中不需要进入肝实质,最大程度上避免肝实质的损伤和出血,做到真正意义上的循肝静脉解剖性切除,精准的管道控制使肝实质离断过程变得更加可控,术中出血减少,保障了手术安全[12]。
4 小结
综上所述,Laennec包膜可以作为解剖性肝切除的解剖标记,指引、规范化肝蒂和肝静脉的解剖分离。Glisson蒂和肝静脉主干与Laennec包膜之间的间隙从肝外延伸至肝内,使术中能够在破坏最少肝实质的情况下沿着潜在间隙进行分离和显露,进而结扎、切断Glisson蒂及肝静脉,简化手术步骤,降低手术难度。随着肝脏解剖学和组织学研究的推进,能量器械的改进,三维重建技术的成熟,以及外科医师对肝脏手术认识的加深,Laennec包膜在解剖性肝切除手术中的地位必将日益凸显,认识、重视、利用Laennec包膜,将推动肝脏外科手术向更加精准、更加安全的方向发展。
参考文献
[1]
CouinaudC. Segmental and lobar left hepatectomies; studies on anatomical conditions[J]. J Chir (Paris), 1952, 68(11): 697-715.
[2]
CouinaudC. Liver lobes and segments: notes on the anatomical architecture and surgery of the liver[J]. Presse Med, 1954, 62(33): 709-712.
[3]
HayashiS, MurakamiG, OhtsukaA, et al. Connective tissue configuration in the human liver hilar region with special reference to the liver capsule and vascular sheath[J]. J Hepatobiliary Pancreat Surg, 2008, 15(6): 640-647. DOI: 10.1007/s00534-008-1336-8.
[4]
SugiokaA, KatoY, TanahashiY. Systematic extrahepatic Glissonean pedicle isolation for anatomical liver resection based on Laennec′s capsule: proposal of a novel comprehensive surgical anatomy of the liver[J]. J Hepatobiliary Pancreat Sci, 2017, 24(1): 17-23. DOI: 10.1002/jhbp.410.
[5]
HuY, ShiJ, WangS, et al. Laennec′s approach for laparoscopic anatomic hepatectomy based on Laennec′s capsule[J]. BMC Gastroenterol, 2019, 19(1): 194. DOI: 10.1186/s12876-019-1107-9.
[6]
余德才. 腹腔镜Glisson鞘肝蒂解剖法肝切除术[J/CD]. 中华肝脏外科手术学电子杂志,2018, 7(4): 270-273. DOI: 10.3877/cma.j.issn.2095-3232.2018.04.005.
[7]
HasegawaK, KokudoN, ImamuraH, et al. Prognostic impact of anatomic resection for hepatocellular carcinoma[J]. Ann Surg, 2005, 242(2): 252-259. DOI: 10.1097/01.sla.0000171307.37401.db.
[8]
HokutoD, NomiT, YasudaS, et al. Does anatomic resection improve the postoperative outcomes of solitary hepatocellular carcinomas located on the liver surface?[J]. Surgery, 2018, 163(2): 285-290. DOI: 10.1016/j.surg.2017.08.024.
[9]
HidakaM, EguchiS, OkudaK, et al. Impact of Anatomical Resection for Hepatocellular Carcinoma With Microportal Invasion (vp1): A Multi-institutional Study by the Kyushu Study Group of Liver Surgery[J]. Ann Surg, 2020, 271(2): 339-346. DOI: 10.1097/SLA.0000000000002981.
[10]
FiguerasJ, Lopez-BenS, LladóL, et al. Hilar dissection versus the "glissonean" approach and stapling of the pedicle for major hepatectomies: a prospective, randomized trial[J]. Ann Surg, 2003, 238(1): 111-119. DOI: 10.1097/01.SLA.0000074981.02000.69.
[11]
李相成,江王杰. 解剖性肝切除的沿革[J]. 外科理论与实践,2020, 25(1): 20-24. DOI: 10.16139/j.1007-9610.2020.01.005.
[12]
CiriaR, BerardiG, NishinoH, et al. A snapshot of the 2020 conception of anatomic liver resections and their applicability on minimally invasive liver surgery. A preparatory survey for the Expert Consensus Meeting on Precision Anatomy for Minimally Invasive HBP Surgery[J]. J Hepatobiliary Pancreat Sci, 2022, 29(1): 41-50. DOI: 10.1002/jhbp.959.
[13]
TakasakiK. Glissonean pedicle transection method for hepatic resection: a new concept of liver segmentation[J]. J Hepatobiliary Pancreat Surg, 1998, 5(3): 286-291. DOI: 10.1007/s005340050047.
[14]
曹君,陈亚进. 浅谈腹腔镜肝切除之入路[J]. 中华外科杂志,2019, 57(7): 503-507. DOI: 10.3760/cma.j.issn.0529-5815.2019.07.005.
[15]
刘荣,刘渠. 重视肝切除的核心策略:血流控制和切面确定[J]. 中华外科杂志,2019, 57(7): 500-502. DOI: 10.3760/cma.j.issn.0529-5815.2019.07.004.
[16]
KiguchiG, SugiokaA, KatoY, et al. Use of the inter-Laennec approach for laparoscopic anatomical right posterior sectionectomy in semi-prone position[J]. Surg Oncol, 2019, 29: 140-141. DOI: 10.1016/j.suronc.2019.05.001.
[17]
KiguchiG, SugiokaA, KatoY, et al. Laparoscopic S7 Segmentectomy using the inter-Laennec approach for hepatocellular carcinoma near the right hepatic vein[J]. Surg Oncol, 2019, 31: 132-134. DOI: 10.1016/j.suronc.2019.10.008.
在有图有真相的时代,一张手术图可能胜过几十甚至几千个文字表达,一段视频,更是几百张图乃至成千上万张图的连续表达。一台手术,大的战略方面, 医生们趋于一致,但在具体处理细节,总是有不同技巧。有时不同的技巧可以达到殊途同归的效果,有时技巧的差别可能对整体的质量与疗效产生影响。对手术视频的观摩,是提升手术技巧最快捷有效的方法。
来源:医梯研习平台
,




