《方法指引》
解答溶液pH变化图像问题三步走
①一看起点:起点描述的是起始液的pH,可以判断起始溶液的酸碱性。若起点pH小于7,则起始溶液为酸性溶液,若大于7则为碱性溶液。
②二看终点:终点描述的是最终所得溶液的pH,据此可判断最终所得溶液的组成成分,若pH小于7,则酸过量;若大于7,则碱过量:若pH等于7,则恰好完全反应,溶液呈中性。
③三看曲线的变化趋势:曲线的变化趋势反映的是整个过程中溶液pH变化情况,要根据反应原理正确判断pH是逐渐增大还是逐渐减小,结合起点pH,可判断滴加的溶液。
在解答强酸强碱之间中和反应的图像题时注意以下几点:
(1)当起点的pH大于7时,原溶液是碱性溶液,此时是向碱中滴加酸;当起点的pH小于7时,原溶液是酸性溶液,此时是向酸中滴加碱。
(2)曲线上pH大于7的点表示溶液中含有的溶质是未反应的碱和生成的盐;曲线上pH等于7的点表示溶液中含有的溶质是生成的盐;曲线上pH小于7的点表示溶液中含有的溶质是未反应的酸和生成的盐。

典型例题
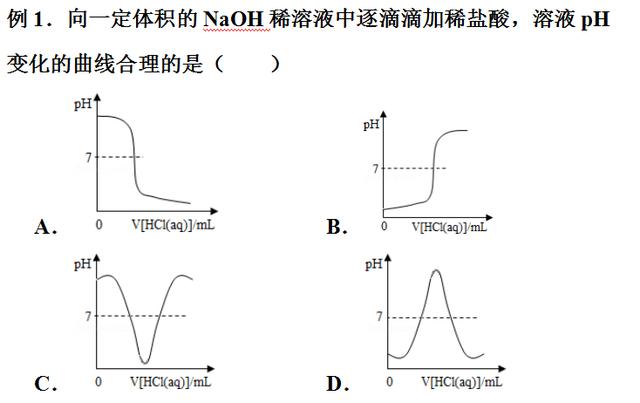
【分析】向一定体积的NaOH稀溶液中逐滴滴加稀盐酸,溶液pH的变化曲线的变化趋势为:原溶液氢氧化钠溶液显碱性,pH值大于7;把盐酸溶液逐滴滴入,与氢氧化钠溶液反应,中和至恰好完全反应,pH值等于7;再滴入盐酸,盐酸过量,溶液呈酸性,pH值小于7。
【解答】解:氢氧化钠溶液显碱性,碱性溶液的pH大于7;向NaOH溶液中不断滴加盐酸溶液时,盐酸与氢氧化钠发生中和反应生成氯化钠和水,生成的氯化钠溶液呈中性,由于氢氧化钠减少,所以溶液的pH不断减小,中和至恰好完全反应,溶液呈中性,溶液的pH等于7;再滴加稀盐酸,盐酸过量,溶液显酸性,溶液的pH小于7。
故A图象溶液pH变化的曲线合理。
故选:A。
【点评】本题难度不是很大,主要考查了中和反应及其应用,掌握溶液的酸碱性和溶液pH大小之间的关系、从数形结合的角度理解中和反应是正确解答本题的关键。

【分析】A.根据c点的pH小于7,溶液显酸性,据此进行分析判断.
B.根据a点的pH大于7,溶液显碱性,据此进行分析判断.
C.根据由a到b点的pH值的变化是从大于7逐渐的减小到等于7,进行分析解答.
D.根据图象中pH值的变化是从大于7逐渐的减小到小于7,进行分析解答.
【解答】解:A.c点的pH小于7,溶液显酸性,故错误;
B.a点的pH大于7,溶液显碱性,溶液中的溶质是硫酸钠和氢氧化钠,故错误;
C.由a到b点的pH值的变化是从大于7逐渐的减小到等于7,可以说明酸和碱发生了中和反应,故正确。
D.由图象可知,pH值是开始时大于7逐渐的减小到7然后小于7,可知原溶液显碱性,然后不断的加入酸性溶液,使pH减小,说明是把稀盐酸滴加到氢氧化钠溶液中,故错误。
故选:C。


【分析】A、根据图象中pH值的变化是从大于7逐渐的减小到小于7,进行分析判断。
B、根据横坐标的含义,进行分析判断。
C、根据A点时溶液的pH大于7,进行分析判断。
D、根据B点时溶液的pH等于7,进行分析判断。
【解答】解:A、由图象可知,pH值是开始时大于7逐渐的减小到7然后小于7,可知原溶液显碱性,然后不断的加入酸性溶液,使pH减小,说明是把稀盐酸滴加到氢氧化钠溶液中,故选项说法错误。
B、是把稀盐酸滴加到氢氧化钠溶液中,a克是指加入稀盐酸溶液的质量,故选项说法错误。
C、A点时溶液的pH大于7,显碱性,氢氧化钠有剩余,A点时,溶液的溶质为氢氧化钠、氯化钠,故选项说法正确。
D、B点时溶液的pH等于7,显中性,由于稀盐酸与氢氧化钠溶液溶质质量分数不一定相同,则稀盐酸和加入的氢氧化钠溶液质量不一定相同,故选项说法错误。

【分析】(1)根据溶液的pH值判断反应的情况;
(2)利用溶质质量=溶液质量×溶质的质量分数分析,
(3)根据氢氧化钠的质量结合化学方程式计算硫酸的质量。

【点评】本题主要考查学生运用化学方程式进行计算和推断的能力,计算时要注意规范性和准确性。

【分析】A、根据在0s至40s之间,溶液的pH小于7,进行分析判断。
B、根据20s时,溶液的pH小于7,进行分析判断。
C、根据60s时溶液的pH大于7,进行分析判断。
D、根据图象中pH值的变化是从小于7逐渐的增大到大于7,进行分析判断。
【解答】解:A、在0s至40s之间,溶液的pH小于7,显酸性,溶液中的溶质为HCl、NaCl,故选项说法错误。
B、20s时,溶液的pH小于7,显酸性,故选项说法错误。
C、60s时溶液的pH大于7,显碱性,取适量所得溶液加入锌粒,没有气泡产生,故选项说法错误。
D、图象中pH值的变化是从小于7逐渐的增大到大于7,可知原溶液显酸性,然后不断的加入碱性溶液,使pH增大,说明是把氢氧化钠溶液滴加到稀盐酸中,故选项说法正确。
故选:D。


【解答】解:A、由图象可知,pH值是开始时大于7逐渐的减小到7然后小于7,可知原溶液显碱性,然后不断的加入酸性溶液,使pH减小,说明是把稀盐酸滴加到氢氧化钠溶液中,故选项说法错误。
B、恰好完全反应时pH等于7,约70秒时pH等于7,恰好完全反应,故选项说法正确。
C、温度的变化,可能是滴加稀盐酸的过程中溶于水造成的,不能直接证明二者发生化学变化,故选项说法错误。
D、中和反应放热,但放热的反应不一定是中和反应,如氧化钙与水反应,故选项说法错误。
故选:B。

【分析】A、根据恰好完全反应时pH等于7,进行分析判断。
B、a点时溶液中的pH大于7,进行分析判断。
C、根据溶液的温度变化图,进行分析判断。
D、根据B点时溶液放出的热量最高,进行分析判断。
【解答】解:A、恰好完全反应时pH等于7,当氢氧化钠溶液加入20克时恰好完全反应,故选项说法错误。
B、a点时溶液中的pH大于7,显碱性,溶质为氢氧化钠和氯化钠,故选项说法正确。
C、由溶液的温度变化图,温度上升是由于中和反应放热,温度下降是因为增加液体降温,故选项说法正确。
D、B点时溶液放出的热量最高,B点时溶液中的溶质为氯化钠,故选项说法正确。

【分析】氢氧化钠和稀盐酸反应生成氯化钠和水;
显酸性溶液和显中性溶液都不能使酚酞试液变色,显碱性溶液能使酚酞试液变红色;
反应物浓度越大,反应速率越快。
【解答】解:A、由图可以看出是向盐酸中加入氢氧化钠溶液,在a、b、c三种曲线所示的实验中,恰好完全反应,即pH=7时,需要氢氧化钠溶液体积相等,因此所用盐酸浓度越大,需要加入的氢氧化钠溶液浓度也越大,V时氢氧化钠溶液过量,所得溶液的pH越大,该选项说法正确;
B、是向盐酸中加入氢氧化钠溶液,在a曲线所示的实验中,若用酚酞做指示剂,酚酞溶液由无色变为红色,该选项说法不正确;
C、在a、b、c三种曲线所示的实验中,由于反应物浓度不同,反应速率不相同,该选项说法不正确;
D、在a、b、c三种曲线中,最终a、b、c都显碱性,该选项说法不正确。
【点评】本题主要考查物质的性质,解答时要根据各种物质的性质,结合各方面条件进行分析、判断,从而得出正确的结论。
,




