反应焓变的计算


变化观念与平衡思想:
能运用化学变化的规律分析说明生产、生活实际中的化学变化
证据推理与模型认知:
能理解、描述和表示盖斯定律计算模型,指出其表示的具体含义,并应用于反应焓变的计算。
科学态度与社会责任:
能举例说明化学在解决能源危机中的重要作用,能分析能源的利用对自然环境和社会发展的硬性。能综合考虑化学变化中的物质变化和能量变化来分析、解决实际问题。在实践中逐步形成节约成本、循环利用、保护环境等观念。

盖斯定的含义和应用、焓变的简单计算

有关能源图片素材

【投影】常见出行方式图片

【引入】人类的衣食住行离不开能源,不同的能源提供给人类的能量也不仅相同。例如不同的燃料产生的热量不同,如何根据需要选择燃料,能否通过计算了解不同燃料所能提供能量的多少?是人们关心的问题,本节课我们一起来学习关于反应焓变的计算问题。
【知识回顾】请根据上节课学习内容写出有关的热化学方程式。
1.已知1mol石墨完全燃烧生成二氧化碳气体,放出393.5kJ的热量,写出石墨完全燃烧的热化学方程式。
2.写出二氧化碳转化为石墨和氧气的热化学方程式 。
【思考】如何获得化学反应焓变的数据?
学生回答:通过实验测定
【思考交流】所有化学反应的焓变都可以通过实验进行测定吗?例如碳和氧气反应生成一氧化碳气体的焓变,能否通过实验进行测定?若不能进行测定你认为原因是什么?
【归纳总结】1.化学反应不计其数,每一个反应在不同温度下的反应焓变又不尽相同,通过实验测定反应焓变工作量大;2.受反应条件的限制,有些反应的焓变很难直接测定。
【质疑】如何得知碳单质与氧气生成CO这一反应的焓变呢?能否利用一些已知反应的焓变来计算其他反应的焓变呢?
【板书】三.反应焓变的计算
【讲述】瑞士化学家盖斯,通过大量实验事实总结出了一个规律,为从理论上计算化学反应热提供了思路。次定律被称为盖斯定律,盖斯被人们称为“热化学之父”。
【自主学习】结合学案问题自主学习教材P7—8页内容。
【板书】1.盖斯定律内容
【投影】

【思考】如何理解盖斯定律?怎么利用盖斯定律进行化学反应焓变的计算?
【板书】2.盖斯定律的理解
3.盖斯定律的应用
【投影】

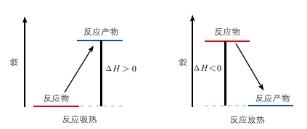
【总结】在给定条件下,一个化学反应的焓变只取决于反应体系的始态和终态,与反应途径无关
【投影讲解】

【总结】有些化学反应进行很慢或不易直接发生,很难直接测得这些反应的反应热,可通过盖斯定律获得它们的反应热数据。
【例】已知在298K时下列反应焓变的实验数据:
(1)C(s,石墨) O2(g)==CO2(g) ΔH1=–393.5 kJ·mol-1
(2)CO(g) 1/2O2(g)==CO2(g) ΔH2=–283.0 kJ·mol-1
计算此温度下C(s,石墨) 1/2O2(g)==CO(g)的反应焓变。
【投影】解题过程,分析讲解

【归纳总结】若一个化学反应的热化学方程式可由另外几个化学反应的热化学方程式相加减而得到,则该化学反应的焓变即为另外几个化学反应焓变的代数和。
【投影总结】盖斯定律应用方法:
1.分析给定反应与所求反应的物质关系和焓变关系。
2.将已知方程式进行变换、加和得到总反应的热化学方程式。
3.将焓变的数值根据关系进行加和计算出所求反应的焓变。
【迁移应用】已知下列反应的反应热为
⑴CH3COOH(l) 2O2(g)== 2CO2(g) 2H2O(l) ΔH1=-870.3 kJ·mol-1
⑵C(s) O2(g)==CO2(g) ΔH2=-393.5 kJ·mol-1
⑶H2(g) 1/2O2(g)==H2O(l) ΔH3=-285.8 kJ·mol-1
试计算下述反应的反应热:2C(s) 2H2(g) O2(g)==CH3COOH(l)
【解析】由题意可知2[(2) (3)]-(1)即得目标方程式。
即:ΔH=2[ΔH2 ΔH3] -ΔH1
ΔH =2×[(-393.5 kJ·mol-1) (-285.8 kJ·mol-1)]-(-870.3 kJ·mol-1)=-488.3 kJ·mol-1
【投影】

【质疑】人类的生活离不开能源,什么是能源?能源的利用存在哪些问题?如何合理利用能源?请大家根据学案问题阅读教材P9页内容。
【板书】4.能源利用
【自主学习】学生阅读教材,完成学案内容
【投影总结】

【质疑】能源危机是当今世界面临的重大问题,如何解决能源危机实现能源的可持续发展呢?
【总结讲述】一方面必须“开源”,开发核能、风能、太阳能等新能源,另一方面需要“节流”,加大节能减排力度,提高能源利用效率。
【投影】

【交流研讨】1.燃料的合理利用和综合利用式提高能源利用效率的重要途径之一。人们通常会从哪些角度、依据什么标准来合理选择燃料?
学生:展示自己观点
【投影总结】

【引入】燃料释放热量的多少通常通过摩尔燃烧焓来衡量。摩尔燃烧焓是指在一定反应温度和压强条件下,1mol纯物质完全氧化为同温下的指定产物时的焓变。并指定物质中所含有的氮元素氧化为N2(g)、氢元素氧化为H2O(l)、碳元素氧化为CO2 (g)。
【投影】几种物质的摩尔燃烧焓

【交流研讨】2.请结合表中几种物质的摩尔燃烧焓数据,评价煤、天然气、氢气、一氧化碳作为燃料的优缺点。完成学案表格
【投影】

【交流研讨】学生完成交流研讨,展示结果
3.目前,煤在我国仍然是第一能源,但是,将煤直接用作燃料,不仅利用效率低,而且会产生大量固体垃圾和多种有害气体,为解决这一问题,工业上通过煤的干馏、气化和液化等方法来实现煤的综合利用,其中,煤的气化试讲煤转化为可燃气体的过程,主要反应为
C(s) H2O(g)

(1) 你认为煤的气化对于提高能源利用效率有哪些价值?
【投影展示】

(2)已知298K、101kPa时,1molH2O(l)变为H2O(g)需要吸收44.0KJ的热量,则上述煤的气化反应的焓变是多少?
【投影展示】

【课堂小结】


本节内容理论性较强,对盖斯定律的理解和应用是难点,不易引起学生的学习兴趣。与旧教材相比本节内容增加了对能源的介绍,因此在设计本节课时,以人类出行的各种方式背后离不开各种各样的能源为问题背景,引入不同能源产生能量的计算问题以及人类对所面临的能源危机的解决问题,激发学生的学习兴趣,同时发展学生科学态度和社会责任的化学学科素养。
,