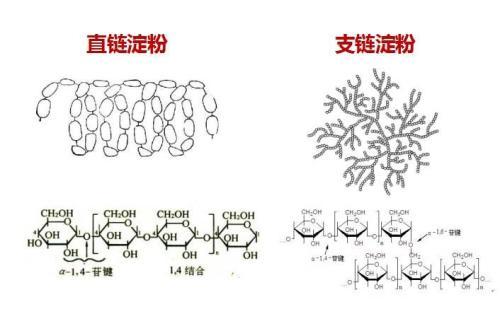
08 月 04 日的《热心肠日报》,我们解读了 9 篇文献,关注:肠道菌群代谢,细菌酶,CAZymes,维生素A,致病菌,pks,糖尿病,生信。
Nature子刊:肠道微生物组中的碳水化合物活性酶(综述)
Nature Reviews Microbiology——[78.297]
① 微生物通过多糖降解酶(CAZymes)降解特定多糖,其基因组含量差异及外界饮食因素影响其在肠道内的丰度;② SusC(转运蛋白)和SusD(聚糖结合蛋白)是多糖利用位点(PUL)的关键,PUL可作为细菌聚糖降解能力的指标;③ 肠道微生物CAZymes通过葡萄糖醛酸化在药物代谢中发挥重要作用,并影响粘膜屏障及参与感染期间逃避宿主免疫反应;④ CAZymes在生产治疗用糖蛋白和人乳低聚糖、聚糖修饰、新酶挖掘以及生产通用O型供体血液方面具有应用潜力。
【主编评语】
肠道菌群基因组的很大一部分用于碳水化合物的摄取和降解,表明了这类分子的重要性。碳水化合物的功能不仅是作为这些细菌的碳源,也是附着于宿主的一种方式,以及宿主感染的一种屏障。发表在Nature Reviews Microbiology上的这篇综述,重点介绍了碳水化合物活性酶(CAZymes)的多样性、肠道微生物如何利用它们降解碳水化合物、这些CAZymes的不同化学机制,以及这些微生物及其CAZymes在人类健康和疾病中的作用,促进了人们对CAZymes和聚糖基本作用的理解。(@EADGBE)
【原文信息】
Carbohydrate-active enzymes (CAZymes) in the gut microbiome
2022-03-28, doi: 10.1038/s41579-022-00712-1
肠道菌群与宿主疾病的关联及其靶向治疗(综述)
Endocrine Reviews——[25.261]
① 环境因素和宿主基因共同塑造肠道菌群,其在免疫调节、阻止病原菌入侵、营养代谢等方面发挥作用;② 无菌小鼠、抗生素处理小鼠模型及粪菌移植等实验表明,肥胖、2型糖尿病等代谢疾病与菌群及其代谢物相关,或存在因果关系;③ 肠道细菌易位及其代谢物(如短链脂肪酸、氨基酸衍生物等)和受其影响的宿主激素(如GLP-1),可影响肝脏、脂肪组织和大脑等多种器官功能;④ 饮食干预、粪菌移植、益生菌及药物等,可通过调节肠道菌群改善代谢疾病。
【主编评语】
在过去的20年中,遗传学和宏基因组学的发展让科学家们得以深入了解肠道菌群组成和功能特性,以及它在各种疾病状态下如何变化。然而,大多数研究都集中在确定肠道菌群和人类疾病状态之间的联系,并使用细胞和动物模型探究因果关系和潜在机制。发表在Endocrine Reviews上的一项综述讨论了肠道菌群与疾病之间的关联,以及肠道细菌如何被靶向治疗和预防代谢疾病。然而,关于宿主-微生物的相互作用仍有许多未知,未来的工作需要进一步描述这些相互作用,以及针对微生物群的干预可能对宿主产生的影响。(@EADGBE)
【原文信息】
The Metabolic Role and Therapeutic Potential of the Microbiome
2022-01-30, doi: 10.1210/endrev/bnac004
Cell子刊:肠道菌群可代谢维生素A
Cell Host and Microbe——[31.316]
① 小鼠肠道菌群能将膳食维生素A(VA)转化为视黄醇,并生成其活性代谢物类视黄醇(如:全反式维甲酸(atRA)和13顺式维甲酸);② 这主要源于对万古霉素敏感的共生厌氧菌;③ 盲肠菌群的体外培养表明,肠道菌群能独立于宿主地通过多步反应将膳食VA代谢为其活性代谢物;④ 特定肠菌(如:肠乳杆菌)具有VA代谢酶(ALDH)活性,其定植可恢复万古霉素处理小鼠的atRA水平,并上调宿主肠道的RA应答基因的表达。
【主编评语】
膳食维生素A(VA)在体内被转化为维甲酸(RA),RA是重要的基因表达调控因子,参与调节一系列生理过程,包括维持肠屏障稳态。此前研究表明,共生菌可以抑制肠上皮细胞将VA转化为RA,提示肠道中还有其他的RA来源。Cell Host and Microbe近期发表的这项研究表明,肠道菌群能将膳食VA转化为RA,是肠腔内VA代谢物的重要来源,为肠道微生物调节宿主生理提供了一种新机制,也提示基于益生菌的维生素A代谢调控干预具有潜力。(@mildbreeze)
【原文信息】
Gut commensals expand vitamin A metabolic capacity of the mammalian host
2022-07-20, doi: 10.1016/j.chom.2022.06.011
Nature 子刊:人肠道菌碳水化合物硫酸酯酶如何识别硫酸化聚糖?
Nature Chemical Biology——[16.174]
① 利用结构生物学,确定了肠道拟杆菌属7个新的S1碳水化合物硫酸酯酶的结构,其中6个是与配体复合的;② S1_46的目标是罕见的宿主糖胺聚糖硫酸盐化,芳香族氨基酸堆积是肠道细菌 S1_16硫酸酯酶的关键;③ 新的硫酸酶结构横跨四个S1亚家族,S1_16和S1_46的结构代表了这些亚家族的新结构;④ S1_11和S1_15的结构揭示了该蛋白的非保守区域,是如何特异性识别相关但不同的糖类目标的。
【主编评语】
硫酸化糖是与真核生物宿主共同进化的微生物群体无处不在的营养来源。细菌通过部署碳水化合物硫酸酯酶来代谢硫酸化糖,以去除硫酸酯。尽管硫酸酶具有重要的生物学意义,但人们对其识别糖类底物的能力的机制仍然知之甚少。Nature Chemical Biology发表的研究,确定了7个拟杆菌属S1碳水化合物硫酸酯酶的结构。总的来说,这项研究增加了我们对碳水化合物硫酸酯酶进化和功能的理解。(@NL)
【原文信息】
Sulfated glycan recognition by carbohydrate sulfatases of the human gut microbiota
2022-06-16, doi: 10.1038/s41589-022-01039-x
西湖大学Nature子刊:跨膜丝氨酸蛋白酶2或能介导索氏梭菌出血毒素的宿主入侵
Nature Communications——[17.694]
① 通过基因筛选、构建基因突变及回补细胞,发现TMPRSS2及岩藻糖基化修饰相关基因是TcsH侵入细胞关键因素;② TMPRSS2的丝氨酸蛋白酶失活不影响介导TcsH入侵,且TMPRSS2可特异性与TcsH结合;③ 岩藻糖基化修饰广泛存在许多细胞表面,基于生化和细胞学实验,发现TMPRSS2和岩藻糖化作用相互独立,两者可竞争性参与TcsH的细胞识别;④ 与野生型相比,TcsH处理Tmprss2-/-小鼠耐受性更高,肠上皮损伤更小,表明TMPRSS2是TcsH重要的病理相关受体。
【主编评语】
索氏梭菌是一种产芽孢的革兰氏阳性细菌,可感染动物和人类,引起组织坏死、肠毒血症、败血症及中毒性休克等严重疾病。致死毒素TcsL和出血毒素TcsH是索氏梭菌主要的毒力因子。近日,西湖大学陶亮及团队在Nature Communications发表最新研究,通过多项生化和细胞试验,发现跨膜丝氨酸蛋白酶2(TMPRSS2)及岩藻糖基化修饰相关基因(GMDS、SLC35C1和FUT4)是TcsH侵入细胞关键因素。此外,动物实验发现TcsH处理后TMPRSS2敲除小鼠结肠上皮损伤明显小于野生型小鼠,表明TMPRSS2是TcsH重要的病理相关受体。总之,该研究首次揭示TMPRSS2是TcsH的肠上皮受体,进一步加深了人们对出血毒素TcsH的认知,值得相关人员关注。(@九卿臣)
【原文信息】
Paeniclostridium sordellii hemorrhagic toxin targets TMPRSS2 to induce colonic epithelial lesions
2022-07-26, doi: 10.1038/s41467-022-31994-x
细菌的pks岛具有哪些功能?(综述)
Trends in Microbiology——[18.23]
① colibactin的合成受到严格控制:它需要有效地生产,并以真核细胞的细胞核或竞争性细菌的基因组为目标,而不损害pks 细菌的DNA;② colibactin的能量密集型合成受到环境、初级代谢化合物的精细调节;③ pks岛与其他合成途径互作,产生次级代谢物,影响适应性、毒性和细菌间竞争;④ pks岛还表达一系列的代谢物,这些代谢物会影响宿主-微生物间互作;⑤ pks岛序列高度保守,或有助于pks 细菌在与细菌和宿主的互作中占优势,有效适应特定生态位。
【主编评语】
colibactin的结构和作用方式及其对癌症的潜在影响已被广泛研究,但对编码colibactin的生物合成基因簇作为细菌基因毒素的内在功能却知之甚少。矛盾的是,这种致病岛也存在于益生菌株以及在橄榄树和蜜蜂消化道上定植的细菌物种中。Trends in Microbiology发表的综述文章,通过总结现有的文献,针对以下问题做了探讨。这个基因组岛到底编码了什么?是什么原因导致了这种基因移动元素的广泛传播?我们对colibactin的生物合成和分泌途径真正了解多少?其固有的目标/功能是什么?文章中把pks岛形象的比喻为一把 "瑞士军刀",或在细菌共生、致病等方面发挥重要作用。(@NL)
【原文信息】
The pks island: a bacterial Swiss army knife? COLIBACTIN: BEYOND DNA DAMAGE AND CANCER
2022-06-04, doi: 10.1016/j.tim.2022.05.010
北京中医药大学:肠道菌群介导肥胖易感人群易患糖尿病
Pharmacological Research——[10.334]
① 队列研究纳入29名肥胖易感(OP)个体,29名对照,筛选并验证糖尿病相关DNA甲基化位点;② 与对照相比,OP组的肠道菌群组成具有差异,FMT证实肠道菌群在诱导糖尿病相关DNA甲基化和糖脂紊乱中发挥作用;③ OP组总短链脂肪酸(SCFA)显著减少,丙酸显著增加,筛出丙酸为OP最具象征意义的SCFA;④ 丙酸诱导cg26345888位点高甲基化,进而抑制靶基因DAB1表达,DAB1与临床上维生素D缺乏密切相关,进而影响糖尿病的发生和进展。
【主编评语】
肥胖易感(OP)个体有明显的肥胖和糖尿病倾向。之前的研究发现OP患者尽管体重和BMI正常,但已经表现出与糖尿病相关的DNA甲基化特征。北京中医药大学的Jin-Yi Wan和姚海强与团队在Pharmacological Research发表文章,发现OP个体具有不同的肠道菌群组成,肠道菌群及其衍生的丙酸诱导特异性DNA甲基化,使OP个体易患糖尿病。提示我们肠道菌群和短链脂肪酸或可作为临床治疗和预防糖尿病的靶点。(@章台柳)
【原文信息】
Gut microbiota induces DNA methylation via SCFAs predisposing obesity-prone individuals to diabetes
2022-07-14, doi: 10.1016/j.phrs.2022.106355
肠道菌群产生的特定多肽可能驱动1型糖尿病的发生发展
PNAS——[12.779]
① 鉴定出P. distasonis表达的hprt4–18可激活T1D患者及NOD小鼠的insB:9–23特异性T细胞;② P. distasonis的定殖可加速NOD小鼠的T1D发展,增加巨噬细胞、树突细胞及破坏性CD8 T细胞,减少Treg;③ 在P. distasonis定殖的NOD小鼠及T1D患者的血清中,可鉴定出P. distasonis反应性抗体;④ 将P. distasonis定殖小鼠的脾细胞过继转移给NOD/SCID小鼠,可增强后者的疾病表型;⑤ 肠道菌群可产生hprt4–18的儿童发展出胰岛自身抗体的比例更高。
【主编评语】
先前研究表明,在1型糖尿病(T1D)中,自身抗体及T细胞可识别胰岛素B链上的insB:9–23表位。PNAS上发表的一项最新研究结果,鉴定出17个肠道菌群多肽与insB:9–23有>50%的一致性,其中Parabacteroides distasonis(P. distasonis)表达的hprt4–18与insB:9–23具有免疫交叉反应,且P. distasonis的定殖可加速NOD小鼠的T1D发展。在T1D患者的血清中可发现P. distasonis的反应性抗体,且肠道菌群可产生hprt4–18的儿童的血清转化率(发展出2个以上胰岛自身抗体)更高。该研究表明,肠道菌群产生的insB:9–23模拟多肽在T1D的发病机制中发挥了重要作用。(@aluba)
【原文信息】
A gut microbial peptide and molecular mimicry in the pathogenesis of type 1 diabetes
2022-07-25, doi: 10.1073/pnas.2120028119
iMeta: 短读长扩增子测序是否适用于菌群功能的预测?
iMeta——[N/A]
① 本文阐述了利用菌群数据集分类谱预测微生物潜在功能之生物学可信度方面的一些问题,作者认为短读长扩增子测序预测菌群功能不应作为生物学推断的唯一基准;② 讨论了标记基因的分类学分辨率、标记基因的基因组内变异以及菌群数据的组成性质;③ 作者认为将菌群功能的实际测定与预测相结合是理解菌群功能的一个好办法;④ 作者认为在功能预测的同时,结合使用组学(如代谢组学)和非组学方法(如qPCR)表征微生物活性对阐明菌群功能至关重要。
【主编评语】
本文观点中,作者阐述了利用分类组成(特别是来源于短读长测序时)预测菌群功能之生物学可信度方面的一些担忧,讨论了标记基因的分类学分辨率、标记基因的基因组内变异以及菌群数据的组成性质。文中作者强调了功能预测对产生和验证假设的重要性。(@刘永鑫-中科院-宏基因组)
【原文信息】
Are short-read amplicons suitable for the prediction of microbiome functional potential? A critical perspective
2022-07-04, doi: 10.1002/imt2.38
感谢本期日报的创作者:赵静,Akkk,MD,NL,Zzz,aluba,刘永鑫-中科院-宏基因组
点击阅读过去10天的日报:
08-03 | 30分Nature子刊:改善全球生物多样性,微生物组有何可为?
08-02 | 3文聚焦肠道IgA,一窥菌群与免疫间的相互作用
08-01 | 7月,最值得看的30篇肠道健康文献!
07-31 | 多视角剖析营养新知,维生素D再成焦点
07-30 | 巧妙改造工程菌,药物递送方法多
07-29 | 中山大学团队突破:锁定保护心血管的肠菌代谢物
07-28 | 今日Nature:揭秘Akk菌调节免疫的分子机制
07-27 | 国内成果小爆发,微生物相关研究多点开花
07-26 | 再添新证:促肠炎,肠道噬菌体的作用不可小觑
07-25 | Cell子刊:胰腺癌如何塑菌群、逃免疫?新“武器”被锁定
,