病例汇报
患者,男性,51岁。
因“口干、多饮、多尿3年余,发热伴腰酸3 d”于2020年4月14日14:07入住内分泌科。
3年前,患者无明显诱因出现口干、多饮、多尿,随机血糖20.3 mmol/L,尿糖3 ,糖化血红蛋白10.5%,诊断“2型糖尿病”,需胰岛素泵控制血糖。
3 d前,出现咳嗽、少痰,有腰酸、腰痛,寒战发热,伴纳差乏力,至外院就诊,予抗感染治疗,症状无明显改善。
1 d前,出现恶心、呕吐,纳差乏力加重,活动后有胸闷,无胸痛,仍有腰酸腰痛。
既往史:
2017年8月有“肾脓肿”病史,后伴有反复泌尿道感染。
体格检查:
体温36.9℃,脉搏104次/min,血压90/60 mmHg,意识淡漠,双肺呼吸音粗,右下肺呼吸音偏低,心律齐。右侧肾区有叩痛,左侧肾区未及叩痛。
辅助检查:
pH 7.24,动脉氧分压74 mmHg,K 3.9mmol/L,Na 116 mmol/L,
血糖> 41.6mmol/L,血乳酸4.7 mmol/L
心肌肌钙蛋白13.30 pg/mL
血常规:白细胞21.35×109/L,血小板24×109/L。
C反应蛋白 >190 mg/L。
血糖39.13 mmol/L,总胆红素30.50 μmol/L,K 4.81 mmol/L,Na 121.0 mmol/L,血尿素氮21.21 mmol/L,血肌酐258.1 μmol/L。
N末端B型利钠肽原12 294.0 pg/mL。
尿常规:尿蛋白3 ,葡萄糖2 ,尿隐3 ,尿酮体1 ,尿白细胞酯酶3 ,白细胞2 598/μL,细菌57 /μL。
胸部CT:两肺炎症。
入住内分泌科后血压最低降至90/45 mmHg,血小板降至24×109/L,请重症医学科会诊。
再次查体:神志清,精神萎,血压低,右肾区叩痛,建议完善腹部CT,留取血培养、尿培养。
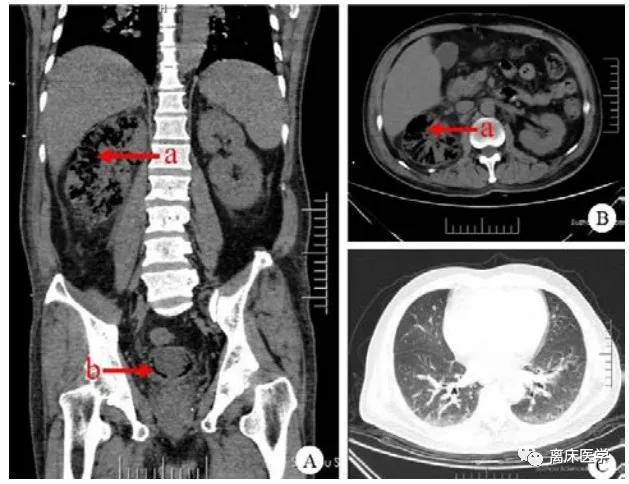
急查腹部CT示右侧肾脏、右侧输尿管及膀胱可见多发气体密度影,考虑气肿性肾盂肾炎(图 1)。
|
|
|
CT影像:A:腹部冠状位CT影像;B:横断位CT表现,a为右侧肾脏多发积气影,部分肾实质被气体替代,b为膀胱内多发积气影;C为肺部CT可见双肺炎症) |
患者于2020年4月14日21:45转至重症医学科,入科诊断:
1)脓毒症、脓毒性休克
2)气肿性肾盂肾炎
3)肺部感染
4)多器官功能障碍综合征
5)糖尿病酮症酸中毒、高血糖高渗状态、2型糖尿病
6)电解质代谢紊乱
7)低蛋白血症
治疗上按脓毒症指南进行液体复苏、血管活性药物应用、控制血糖、器官功能保护、纠正电解质紊乱等综合治疗,并经验性予亚胺培南西司他丁1.0 g/8 h静脉滴注抗感染;同时请泌尿外科会诊,反复与家属沟通后,于4月15日14:00拟行“右肾周切开引流术(备右肾切除术)”。
术中可见右侧肾脏及周围结构不清,肾周脂肪灶性改变,肾脏及肾周多处积脓,右肾肿大,质地软,局部皮质糜烂(图 2),考虑患者右肾无保留价值,为了有效控制感染,术中再次与患者家属沟通后行右肾(包膜下)切除术。
术后继续亚胺培南西司他丁抗感染等治疗,去甲肾上腺素逐步减量,2 d后停用。

右侧肾脏大体标本及组织切片:
A:右侧肾脏大体标本,可见肾脏有多处积脓,局部皮质糜烂;
B:肾组织切片标本,a为基本正常肾小球,b为肾小管内炎性细胞及组织碎片,形成管型;c为硬化的肾小球,HE×400
4月20日血培养、尿培养及右肾引流液培养回报均阳性:大肠埃希菌,药敏亚胺培南西司他丁敏感。
白细胞、降钙素原、C-反应蛋白等感染指标逐步下降,术后第4天PLT升至77×109/L(图 3)。
|
|
|
感染指标及血小板变化趋势[4月15日术后,PCT、CRP及WBC呈明显下降趋势,PLT逐渐升至正常 |
术后第6天患者生命体征平稳,转至泌尿外科继续抗感染、脏器功能保护、营养支持等治疗,并于5月6日痊愈出院。
随访3个月,患者复诊无不适主诉,血糖控制良好,肾功能正常。

气肿性肾盂肾炎是一种迅速进展的肾实质及肾周感染性疾病,导致集合系统、肾实质及肾周积气,该病罕见但致死率高。
EPN致病因素主要有:
⑴血糖控制欠佳。文献显示约90%的患者合并糖尿病,当血糖水平控制不佳时,肾脏组织和尿路中的葡萄糖被产气菌酵解,产生大量二氧化碳、氢气、氨气等。
⑵尿路感染。产气菌中大肠杆菌占50%~70%,其次为肺炎克雷伯菌及变形杆菌等,血培养、尿培养或穿刺液培养常为阳性。
⑶免疫力低下。
⑷结石、先天性尿路狭窄及肿瘤等导致的尿路梗阻。
本病例是反复尿路感染合并糖尿病患者,血糖控制欠佳,大肠埃希菌感染后诱发无氧代谢,从而导致肾脏及周围组织内气体形成。
此外,腹部CT检查是确诊的首选方法,其影像表现具有特异性,主要为肾实质广泛破坏,肾皮质呈波浪状改变等,气肿可波及肾周、输尿管、膀胱甚至腹腔。
有文献提出根据CT气肿波及范围、临床诊治及预后将EPN分为4级:
1级,气体局限于集合管系统;
2级,气体局限在肾实质内;
3a级,气体或脓肿播散到肾周围组织;
3b级,气体扩散到肾筋膜下;
4级,两侧肾气肿性肾盂肾炎或孤立肾的气肿性肾盂肾炎。
该患者气肿性肾盂肾炎导致脓毒症、脓毒性休克,积极有效的液体管理、正确使用抗生素、维持血流动力学稳定、控制血糖、营养支持等辅助治疗与良好的预后密切相关。
严重脓毒症的发展导致围术期手术和麻醉的风险也相应增加,围术期脓毒症的积极治疗非常重要,它为手术赢得机会,并可降低病死率。
EPN外科干预措施包括经皮肾穿刺引流术、肾切开引流术、肾切除术等。
20世纪80年代以前外科治疗方案主要以开放性切开引流术、肾切除术联合抗生素治疗为主。
1986年,EPN患者首次行经皮肾穿刺引流术,术后恢复良好。此后,经皮肾穿刺导管的发展使经皮肾穿刺引流治疗EPN成为可能。
目前,经皮肾穿刺引流结合内科治疗是创伤最小、效果最好的治疗方式,治愈率为30%~100%,病死率最低降至13.5%。
文献显示,EPN患者的手术方式选择需结合CT分级,对于2级以下患者内科治疗或联合经皮肾穿刺即可好转;3级合并2个以下危险因素,可尝试切开引流术,引流无效者应行肾切除术;而对于3级且有≥2个危险因素者,立即行肾切除术是最佳选择。4级患者以保留肾脏为原则,先尝试引流,并随时做好肾切除的准备。
根据本例患者病情及腹部CT情况,符合3级,存在2个危险因素,经皮肾穿刺引流不首选,初拟肾脏切开引流(备右肾切除术)。
患者手术必要性、风险性及手术方式充分告知患者家属,家属表知情理解,同意手术。
结合术中探查发现:感染灶来自肾实质,无肾积水,亦非肾盂内脓尿,故无法行肾盂内引流术;
肾实质感染灶为坏死性组织合并气体,肾切开很难获得通畅引流;
另外术中探查发现患侧肾内已基本无正常组织结构、其间被坏死组织填充,考虑肾脏已无功能,行病灶肾切除可快速控制脓毒症,故予行患侧肾脏切除术。
此外,影响EPN预后的主要危险因素有:高龄、高体质量指数、血小板减少(PLT < 60×109/L)、急性肾功能损害(Cr > 124 μmol/L)、意识障碍和休克。该患者内科治疗为基础,手术及时干预,随访中肾功能正常,预后良好。
,