4.3.3影响化学平衡移动的因素
一切化学反应平衡都是相对的,有条件的,是一种动态平衡外界条件改变,平衡遭到破坏,正逆反应速率就不再相等,经历一段时间会建立新的平衡
化学平衡的移动:因外界条件改变,使可逆反应从一种平衡状态转变到另一种平衡状态的过程

化学平衡的移动
4.3.3.1浓度的影响

合成氨的反应是最简单的化学平衡移动的反应
在一定温度下,
1)此反应达到平衡态,此时υ正=υ逆;
2)增大NH3的浓度或者降低H2/N2浓度,υ正<υ逆,平衡向左移动;
3)降低NH3浓度或者增大H2/N2浓度,υ正>υ逆,平衡向右移动
化学平衡朝着浓度改变的反方向移动(加入H2/N2,是H2/N2增加的过程,化学平衡移动的方向是H2/N2减少的方向,即向着生成NH3和消耗H2/N2的方向进行)
在合成氨的反应中,N2取自于空气,成本低,H2取自于煤炭,成本相对高,在合成过程中,加大N2的量,使得H2的转化率达到90%以上。
在合成氨的反应中,把生成的氨气通过工艺及时移走,保证反应向右进行
增大反应物浓度或者减少产物浓度,使得反应向正反应方向进行;
减少反应物浓度或者增大产物浓度,使得反应向逆反应方向进行
4.3.3.2压力的影响

系统压力的改变主要对气态反应起作用
结论:增加体系总压力,平衡将向气体分子总数减小的方向移动
工业合成氨过程中,增大系统压力能使平衡向右移动,一般情况下,合成氨工艺的系统压强使30MPa左右
另:压力的影响(惰性气体)
惰性气体:泛指存在于系统中,但不参与反应的气体(不同于元素化学的惰性气体)
对于气相化学反应来说,当温度和压力都一定时,若往反应系统中充入惰性气体时,往往会改变系统达到平衡时的组成
1)恒温恒压下,总压不变,加入惰性气体,相当于减少了每一种物质的分压,与降低体系总压的效应是一致的;
2)恒温恒容下(反应物浓度和分压力没有发生改变),加入惰性气体平衡不发生移动
课堂习题:在NaOH HAc=NaAc H2O的醋酸和氢氧化钠的酸碱中和反应中,把压强从100kPa提高到200kPa后,化学反应向哪个方向移动(答案见文后评论区)
4.3.3.3温度的影响

化学平衡朝着温度改变的反方向进行
温度升高,反应朝着吸热的方向进行。温度升高时,环境给反应提供了更多的热量,丹樱就朝着热量减少的方向进行,反之亦然。(如果一个反应是放热反应,其逆反应一定是吸热反应,反之亦然)。
举例说明:
化学热处理高温气相渗碳中存在这样的反应:2CO(g)⇋C(s) CO2(g),试计算298.15K时和1173K时的标准平衡常数
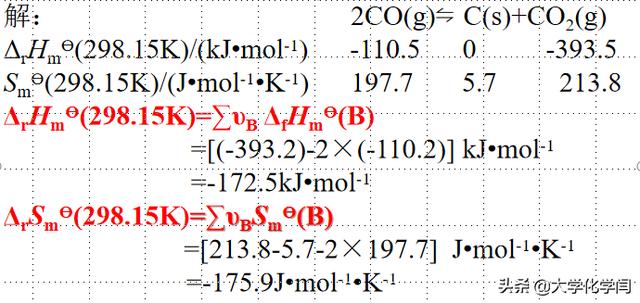
利用盖斯定律求出来焓变和熵变

利用范特霍夫方程求出来标准平衡常数
计算熵变和焓变的时候,注意量纲要统一。最后的结果,用科学计数法表示,切忌使用e指数表示,这是一个初学者易犯的错误,由于得到的最终值是在狄然对数下得到的,为了方便就直接写成以e为底的指数。
4.3.3.4勒夏特列原理(吕查德里)
Le Chatelier,法国化学家,在中学化学里,这个名字被翻译成勒夏特列,但在大学化学里,更多时候被翻译成吕查德里,虽然名字不同,但确确实实是同一个人,出现这种现象的原因是因为这是一个法国人,这个名字在汉字中出现,最开始是从英语翻译过来的。法语先翻译成英语,英语再翻译成汉语,传话传的多了,就传的走样了。
平衡移动原理:对于一个平衡体系来说,如果改变能影响平衡的任何一个条件,平衡就朝着能减弱这种改变的方向进行。
1)反应物浓度增加时,平衡向着反应物浓度减少的方向进行;
2)增大压力时,系统朝着减小压力的方向进行;
3)提高温度时,平衡向温度降低的方向进行
现在我们再看看合成氨的反应为什么要高温高压

先说高压:增大压力,化学平衡朝着压力减少的方向进行,所以反应要在高压下进行,一般是28-30MPa(1个大气压大约0.1MPa)的压力下反应
再说温度:正反应是个放热反应,原则上温度越低,反应越有利于氨的合成,从热力学上讲,这个反应是要求低温的,那为什么还要在400-500℃下进行呢?这是因为这个反应的速率受温度影响很大,越低的温度反应速率越慢,所以这个反应就需要一定的温度来保证反应速率。
合成氨的反应反应控制条件就是:
1,超过量的空气(直接用空气替代氮气,但要循环使用,防止热量流失)
2,足够反应的温度(一般不小于400℃,但也不会超过500℃)
3,足够大的压力(原则上压力越大越好,但要考虑到压力设备的抗压能力)
4,及时除去生成的氨气,降低产物的浓度(除去氨气的方法主要是用水吸收。吸收后稍微加热,氨气还会从水中释放出来。)
下一节我们讲氧化反应反应与原电池
,




