高考化学解题方法——电化学篇
2021.05.19
近几年,高考化学中电化学部分的题目解题方法具有很强的一致性,甚至不用读题就可以有非常明确的思路。正所谓,一招鲜吃遍天,掌握了这种解题思路,高中电化学从此没有难题!
一、基础知识
1.1 原电池
以自发进行的氧化还原反应为基本反应
1.2 电解池
放电顺序:
a)阴极:阳离子放电
Ag > Fe3 > Cu2 > H (酸) > Pb2 > Sn2 > Fe2 > Zn2 > H (水) > Al3 > Mg2 > Na > Ca2 > K
b)阳极:惰性电极(Pt, Au, 石墨)只导电不放电
活性电极材料 > S2- > I- > Br- > Cl- > OH-(水) > 含氧酸根 > F-
注意事项:
- 阴极中,Fe3 、Fe2 放电顺序。
- 阴极中,H 由酸或水提供时的放电顺序。
- Al3 及其之后的阳离子在水溶液中不会放电,所以冶炼相关金属需要电解非水环境。
- 阳极中,阴离子在水溶液中不放电。
二、做题思路
2.1 总体思路(分清池,判电极,反应式,可解题):
1)分清原电池、电解池;
2)判断正、负极,或阴、阳极;
3)找出电极反应和电极附近的反应;
4)开始解题。
2.2 考察知识点:
2.2.1 电极方程式的书写(严格按照书写顺序)
1)变价物质和得失电子
2)得失电子守恒配平
3)电荷守恒配平
4)原子守恒配平
必须考察环境:非水体系,某些离子可以存在,如O2-;含水体系,分为酸性、中性、碱性环境。
有机物参与的反应会考察有机物中元素的化合价。
2.2.2 电解质溶液中阴阳离子的移动方向和数目
将某一电极室看作一个整体,整个电极室必须处于电中性状态,由电子得失引起的电极室电荷变化,必定会引发离子移动,最终电极室必须保持电中性。如,负极室失电子造成正电荷堆积,可以将负极室正电荷移除或引入负电荷,由此来判断离子的移动方向。同理,既然将电极室作为一个整体,那么电极室失去1mol电子,为了保持电中性,就要补充1mol正电荷或失去1mol负电荷,据此计算发生移动的阴阳离子的数目。
2.2.3 电极室中溶液质量的变化
将电极室中的溶液看作一个整体,考察外界对其的影响,比如向其中加入物质、通过膜的离子交换等。
2.2.4 离子交换膜
以实验目的为目标,参考电解质溶液的成分和离子的移动方向,选择合适的离子交换膜达到实验目标。
2.2.5 计算题
计算题以电子为研究主体,分为三个部分:1.在整个电路中电流处处相同;2.在两个电极上放电的物质,其得失电子守恒;3.电极附近发生的反应。
三、高考例题:
(2020山东卷)10.微生物脱盐电池是一种高效、经济的能源装置,利用微生物处理有机废水获得电能,同时可实现海水淡化。现以NaCl溶液模拟海水,采用惰性电极,用右图装置处理有机废水(以含CH3COO-的溶液为例)。下列说法错误的是( )
A.负极反应为CH3COO- 2H2O-8e-=2CO2↑ 7H
B.隔膜1为阳离子交换膜,隔膜2为阴离子交换膜
C.当电路中转移1 mol电子时,模拟海水理论上除盐58.5 g
D.电池工作一段时间后,正、负极产生气体的物质的量之比为2∶1

解题思路:
1.分清池:原电池
2.判电极:由乙酸根变为CO2可知,此极失电子,故a极为负极,b极为正极
3.反应式:负极:CH3COO- 2H2O-8e-=2CO2↑ 7H ;正极:2H 2e- = H2
4.开始解题:
A 符合得失电子守恒,电荷守恒,原子守恒和所处的环境,正确。
B 实验目的为淡化海水,即钠离子和氯离子要进入到正负极室。负极室失去电子,正电荷堆积,所以需要氯离子中和正电荷,所以隔膜1应为阴离子交换膜,相似的隔膜2为阳离子交换膜,错误。
C 转移1mol电子即负极室多了1mol正电荷,正极室多了1mol负电荷,分别需要1mol氯离子和钠离子来中和电荷,即1mol NaCl,58.5g,正确。
D 负极:CH3COO- 2H2O-8e-=2CO2↑ 7H ;正极:H 2e- = H2,得失电子守恒,转移8mol电子生成H2和CO2分别为4mol和2mol,正确。
选B
2021.05.28补充:
1.原电池和电解池的能量变化,开始学习的时候都是电能与化学能之间的相互转化,但在实际问题中,设计电池的思路可能只是一个能量的转换装置。如题,我国科学家在天然气脱硫研究方面取得了新进展,利用如图装置可发生反应:H2S+O2===H2O2+S,已知甲池中发生的反应为
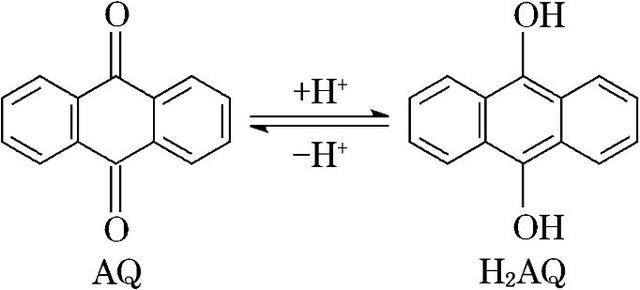

此类题目的能量转化要以题目中装置的实际用途为准。此装置的设计目的是将H2S转化为S,而构成原电池的氧化还原反应是由光驱动的,所以能量的转化方式是光能化学能电能化学能。
高考题解析链接:
2020全国I卷
2020全国II卷
2020全国III卷
2021全国甲卷
2021全国乙卷
2021山东卷
2022全国甲卷
2022全国乙卷
2022山东卷
修改日期:
2021.05.19初稿
2021.05.28补充
2021.05.31补充离子移动和计算的思路
2021.06.01修正了做题思路
2021.06.20 补充了2021全国I卷
2022.07.14 在小董的审阅下,稍作修改
2022.07.20 完成了2020-2022年山东卷和全国卷中电化学的解析
,




